
在50 mL 0.2 mol·L-1 CuSO4溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中CuSO4溶液的浓度________(填“增大”、“减小”或“不变”)。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是________________________________________________________________________
________________________________________________________________________。
(3)若阳极为纯锌,阴极为铜片,如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是________________________________________________________________________
________________________________________________________________________。
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
某同学探究SO2有关性质。
(1)将SO2通入BaCl2溶液中,将所得溶液分成2份,在第一份中加入NaOH溶液,在第二份中滴入FeCl3溶液,两份都有白色沉淀。BaCl2溶液中通入SO2气体的现象为 ▲ 。在第二份溶液中滴入FeCl3溶液时,SO2表现 ▲ 性,反应的离子方程式为 ▲ ,生成沉淀的化学式为 ▲ 。
(2)下列不能用来吸收SO2气体的是 ▲ 。
A.KMnO4(aq) B.过量氨水 C.石灰水 D.盐酸
(3)工业废气含SO2为7%(体积分数),在同温同压下,将以上废气用废气中的O2氧化含SO3。反应后气体体积为原来气体的96.64%。则SO2的转化率为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积相同的密闭容器中,分别充入等量的氮气和氢气,在不同温度下发生反应:N2(g)+3H2(g)
 2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
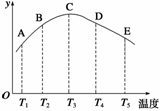
(1)A、B、C、D、E五点中,肯定未达平衡的点是
________________________________________________________________________。
(2)此可逆反应的正反应是__________热反应。
(3)AC曲线是增函数曲线,CE曲线是减函数曲线,试从化学反应速率和化学平衡的角度分析,并说明理由
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
与[H+]·[OH-]=KW类似,FeS饱和溶液中存在:FeS(s)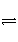
 Fe2+(aq)+S2-(aq),[Fe2+]·[S2-]=Ksp。常温下Ksp=8.1×10-17 mol2·L-2。
Fe2+(aq)+S2-(aq),[Fe2+]·[S2-]=Ksp。常温下Ksp=8.1×10-17 mol2·L-2。
(1)理论上FeS的溶解度为________________,而事实上其溶解度远大于这个数值,其原因可能是________________________________________________________________________
________________________________________________________________________。
(2)又知FeS饱和溶液中[H+]与[S2-]之间存在以下限量关系:[H+]2·[S2-]=1.0×10-22 mol3·L-3,为了使溶液中[Fe2+]达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的[H+]为________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在水中加等物质的量的Ag+、Pb2+、Na+、SO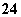 、NO
、NO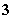 、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铜电极的叙述不正确的是( )
A.在镀件上镀铜时镀件作阴极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜作阳极
D.用电解法精炼粗铜时纯铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时( )
A.粗铜接电源负极
B.纯铜作阳极
C.杂质都将以单质形式沉积到池底
D.纯铜片增重2.56 g,电路中通过的电子为0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的①氨水、②氯化铵、③碳酸氢铵、④硫酸氢铵、⑤硫酸铵5种溶液中[NH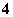 ]的大小顺序是____________________,溶液pH的大小顺序是________________________________________________________________________。
]的大小顺序是____________________,溶液pH的大小顺序是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四组原电池放电后,电解质溶液质量增加,且在正极上有单质生成的是( )
A.Cu、Ag、AgNO3溶液  B.Zn、Cu、稀硫酸
B.Zn、Cu、稀硫酸
C.Fe、Zn、CuSO4溶液 D.Fe、C、Fe2(SO4)3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com