
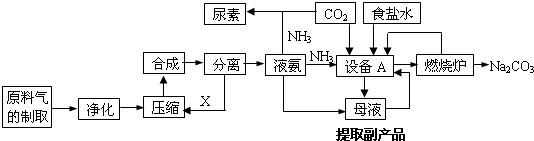
分析 (1)反应物为甲烷和水,条件是高温、催化剂,产物之一是氢气,甲烷完全燃烧产物是二氧化碳,不完全燃烧产物为一氧化碳,据此写出即可;
(2)依据反应原理推断设备A的名称以及书写化学反应方程式即可;
(3)依据反应中的生成物回答需要的原料,依据化学反应原理写出化学反应方程式;
(4)依据纯碱的用途回答;
(5)①依据洗涤沉淀的方法回答;
②依据质量分数的计算方法,计算即可.
解答 解:(1)依据题给的信息,甲烷与水在高温催化剂作用下生成二氧化碳(或一氧化碳)和氢气,故化学反应方程式为CH4+2H2O $\frac{\underline{\;催化剂\;}}{高温}$CO2+4H2或CH4+H2O$\frac{\underline{\;催化剂\;}}{高温}$CO+3H2,故答案为:CH4+2H2O $\frac{\underline{\;催化剂\;}}{高温}$CO2+4H2或CH4+H2O$\frac{\underline{\;催化剂\;}}{高温}$CO+3H2;
(2)在生产中,设备A中应生成目标产物纯碱,故A为沉淀池,发生的反应为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,故答案为:沉淀池;NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;
(3)副产物为氯化铵,需要引入氯离子,且目标产物为纯碱,故在通入氨气的同时,加入NaCl,尿素的水解生成氨气和二氧化碳,故反应为:CO(NH2)2+H2O=2NH3↑+CO2↑,故答案为:NaCl;CO(NH2)2+H2O=2NH3↑+CO2↑;
(4)纯碱在日常生活中应用广泛,常用于制玻璃、制肥皂、造纸、纺织、印染等,故答案为:制玻璃、制肥皂;
(5)①检验沉淀是否洗净的方法为:往少量的最后一次洗涤所得滤液中加入稀H2SO4溶液(或AgNO3溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净,故答案为:往少量的最后一次洗涤所得滤液中加入稀H2SO4溶液(或AgNO3溶液),若产生白色沉淀,则沉淀没有洗涤干净,若无白色沉淀,则沉淀已洗涤干净;
②生成ng固体为BaCO3,物质的量为:$\frac{n}{197}$,故碳酸钠的质量为:$\frac{n}{197}×106$,故氯化钠的质量为$\frac{(m-106n)}{197}$,故质量分数为$\frac{\frac{m-106n}{197}}{m}$×100%=(1-$\frac{106n}{197m}$)×100%,故答案为:(1-$\frac{106n}{197m}$)×100%.
点评 本题主要考查的是氨气的工业用途、化学反应方程式的书写等,锻炼了同学们综合分析问题的能力.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
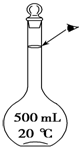 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | 石灰石 | 稀的碳酸钠溶液 | 溶解度:碳酸钠>碳酸氢钠 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸有脱水性、强氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | 浓硫酸具有强氧化性 | |
| D | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 酸性:盐酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 请回答:
请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com