
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
科目:高中化学 来源: 题型:
【题目】在有机合成中官能团的引入或改变是极为重要的,下列说法正确的是( )
A.甲苯在光照下与Cl2反应,主反应为苯环上引入氯原子
B.引入羟基的方法常有卤代烃和酯的水解、烯烃的加成、醛类的还原
C.将CH2=CH—CH2OH与酸性KMnO4溶液反应即可得到CH2=CH—COOH
D.HC≡CH、(CN)2、CH3COOH三种单体在一定条件下发生加成、酯化反应即可得到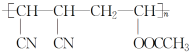
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两份过量的锌粉 a、b 分别加入定量的稀硫酸,同时向 a 中加入少量的 CuSO4 溶液,产生H2 的体积 V(L)与时间 t(min)的关系正确的是( )。
A.
B.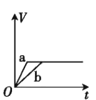
C.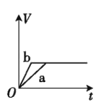
D.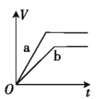
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物通过浓硫酸时,浓硫酸的质量增加了7.2g;再通过灼热的氧化铜时,氧化铜的质量减少了3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。该有机物的化学式是( )
A.C2H4B.C2H6OC.C2H6O2D.C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL1的盐酸,测得溶液中的CO32、HCO3、AlO2、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1 = 4.3×107,K2 = 5.6×1011;Al(OH)3的酸式电离平衡常数K=6.3×1013)

A. a曲线表示的离子方程式为:AlO2+4H+ = Al3+ + 2H2O
B. M点时生成的CO2为0.05 mol
C. 原混合溶液中的CO32与AlO2的物质的量之比为1:2
D. V1:V2=1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请运用原电池原理设计实验,验证 Cu2+、Fe3+氧化性的强弱。请写出电极反应式。
(1)负极 __________________________
(2)正极 __________________________________
(3)并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路中电子流向。________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 NaOH 和Na2CO3 混合溶液中滴加 0.1 mol·L1 稀盐酸,CO2 的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )
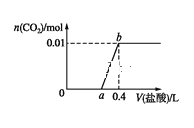
A.在 0~a 范围内,发生中和反应和 CO32-+H+=HCO3-
B.ab 段发生反应的离子方程式为: CO32-+2H+ CO2 +H2O
C.a=0.2
D.原混合溶液中NaOH 与 Na2CO3 的物质的量之比为 1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com