
下列说法中正确的是
A.分子中键能越大,键长越长,则分子越稳定
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.在化学反应中,某元素由化合态变为游离态,该元素被还原
D.电子层结构相同的不同离子,其半径随核电荷数增多而减小
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.臭氧(O3)是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂
B.人造纤维可利用竹子、棉花、麻类的纤维材料制成,而合成纤维是利用自然界的非纤维材料(如石油、煤)通过化学合成方法得到
C.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
D.有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH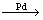
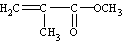 ,其过程符合绿色化学的原则
,其过程符合绿色化学的原则
查看答案和解析>>
科目:高中化学 来源: 题型:
用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率 ,具体情况如图所示。
,具体情况如图所示。
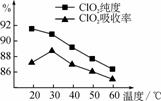
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO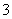 氧化成SO
氧化成SO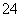 ,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+===Cl-+5Fe3++2H2O
14H++Cr2O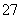 +6Fe2+===2Cr3++6Fe3++7H2O
+6Fe2+===2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96 L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
C.含1 mol FeCl3的溶液中Fe3+的个数为NA
D.1.8g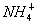 中含有的电子数为0.1NA
中含有的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
1 L某混合溶液中可能含有的离子如下表:
| 可能大量含有的阳离子 | H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 | Cl- Br- I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生 沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
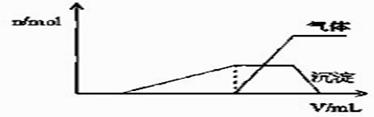
①则该溶液中确定含有的离子有 ; ②不能确定是否含有的阳离子有 , ③要确定其存在可补充做的实验是 ; ④肯定不存在的阴离子有 。
(2)经检测,该溶液中含有大量的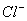 、
、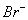 、
、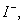 若向1 L该混合溶液中通入一定量的
若向1 L该混合溶液中通入一定量的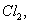 溶液中
溶液中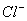 、
、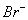 、
、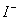 的物质的量与通入
的物质的量与通入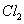 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积 (标准状况) | 2.8 L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入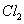 的体积为2.8 L时,溶液中发生反应的离子方程式为 。 ②原溶液中
的体积为2.8 L时,溶液中发生反应的离子方程式为 。 ②原溶液中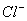 、
、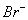 、
、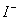 的物质的量浓度之比为 。
的物质的量浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L SO3中所含有分子数为NA
B.常温下,28 g 乙烯和丙烯的混合物中所含化学键一定为6NA
C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定为4NA
D.1 L 1mol/L NH4NO3溶液中氮原子数目小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
家用管道煤气的主要成分是CO、H2、CH4,取1 L管道煤气充分燃烧需要同温同压下的空气5 L(氧气的体积分数为20%),则CO、H2、CH4的体积比不可能
A.1∶1∶1 B.1∶1∶2 C.2∶4∶3 D.1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示。下列说法正确的是
A.甲是N2O4
B.a点处于平衡状态
C.t1~t2时间内v正(乙)<v逆(甲)
D.反应进行到t2时刻,改变的条件可能是升高温度
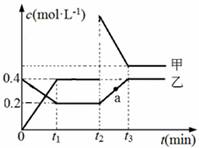
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在体积为3 L的密闭容器中反应CO(g)+2H2(g)  CH3OH(g) ΔH=a kJ·mol-1,ΔS=b J·mol-1·K-1(a、b均为正数),达到化学平衡状态。
CH3OH(g) ΔH=a kJ·mol-1,ΔS=b J·mol-1·K-1(a、b均为正数),达到化学平衡状态。
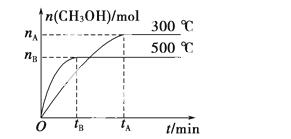
(1)500 ℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是________(填字母)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(3)300 ℃时,将容器的容积压缩到原来的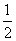 ,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时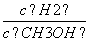 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com