
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: 
(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表: 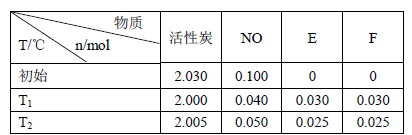
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。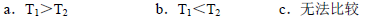
(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: 则
则
正极反应式:___ ,电池总反应式 。
(1)5、4、6、5、4、2、6(2)C(s)+H2O(g)=CO(g)+H2(g),ΔH=+131.6 kJ?mol—1(3)①Ⅰ.0.5625 Ⅱ.c(4)c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)(5)O2 +2CO2+4e-=2CO32-, 2CO+O2=2CO2
解析试题分析:(1)反应中C元素的化合价由0升高为+4价,一个碳化合价变化4,Cr元素的化合价由+6价降低为+3价,1个K2Cr2O7化合价变化6,4和6的最小公倍数为12,由化合价升降总数相等可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,由于产物中有Cr2(SO4)3,所以未知的反应物为H2SO4,最后由质量守恒定律可知得化学反应为3C+2K2Cr2O7+8H2SO4═3CO2+2K2SO4+2Cr2(SO4)3+8H2O(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1(3)Ⅰ、平衡时c(NO)=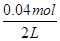 =0.02mol/L,c(N2)=c(CO2)=
=0.02mol/L,c(N2)=c(CO2)=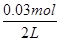 =0.015mol/L,故T1℃时该反应的平衡常数为K1=
=0.015mol/L,故T1℃时该反应的平衡常数为K1=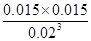 =
=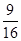 =0.5625;Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;(4)NaOH先与CO2反应生成CO32-离子后过量CO2与再CO32-离子反应生成HCO3-离子,由题意知有0.4mol CO2,200ml 3mol/LNaOH溶液中含有NaOH0.6mol,即NaOH先完全反应生成Na2CO3后再生成NaHCO3:
=0.5625;Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;(4)NaOH先与CO2反应生成CO32-离子后过量CO2与再CO32-离子反应生成HCO3-离子,由题意知有0.4mol CO2,200ml 3mol/LNaOH溶液中含有NaOH0.6mol,即NaOH先完全反应生成Na2CO3后再生成NaHCO3:
CO2+2NaOH=Na2CO3 CO2+Na2CO3+H2O =2NaHCO3
1 2 1 1 1 2
0.3 0.6 0.3 0.1 0.1 0.2
所得溶液中有0.2mol Na2CO3,0.2mol NaHCO3,又钠离子没有参与反应反应其浓度最大,CO32-水解生成OH-和HCO3-,而HCO3-水解大于电离,生成OH-,使得c(HCO3-) > c(CO32-),c(OH-) > c(H+),故c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)(5)该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-电池总反应式2CO+O2=2CO2
考点:氧化还原反应方程式的配平;热化学方程式;水解与电离;化学平衡的计算;化学平衡的影响因素;化学电源新型电池


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
将5.5 g铁铝混合物粉末加入900mL 1.00 mol/L HNO3溶液中,充分反应后,得a L(标准状况)NO气体。
(1)HNO3是否过量___________。
(2)若a=3.36L(标准状况),则混合物中铝的质量分数为_________%。
(3)若a=3.36L(标准状况),往反应后的溶液中加入___________ mL 1.000 mol/L NaOH溶液时生成的沉淀量最大,还要加________ mL 1.000 mol/L NaOH溶液才能使沉淀的量保持不变。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法有两种。
方法1 还原沉淀法
该法的工艺流程为 。
。
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。
Cr2O72-(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O72-的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硝酸铈铵[(NH4)2Ce(NO3)6]广泛应用于电子、催化工业,其合成路线如下:
(1)已知(NH4)2Ce(NO3)6受热易分解,某科研小组认为反应原理如下,请补充完整:(NH4)2Ce(NO3)6 CeO2·8OH + 8_____↑;CeO2·8OH
CeO2·8OH + 8_____↑;CeO2·8OH CeO2+ 4H2O↑+2O2↑。
CeO2+ 4H2O↑+2O2↑。
在空气中加热(NH4)2Ce(NO3)6,除固体颜色有变化外,还可观察到的现象是_________。
(2)步骤Ⅰ中,将Ce(NO3)3·6H2O配成溶液,保持pH到4~5,缓慢加入H2O2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到Ce(OH)4沉淀。该过程中参加反应的氧化剂与还原剂物质的量之比为___________。
(3)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=___________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10—5mol·L-1,需调节pH为______以上。
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2Ce(NO3)6在不同温度、不同浓度硝酸中的溶解度,结果如图。从图中可得出三条主要规律:
① (NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;
② _____________________________________________;
③ _____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是: ;
②写出由CaCl2通过化合反应制备CaCl的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g) (I)
(1)反应(I)中氧化剂是_______。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____
_______________________________________________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1,假设溶液的体积是bL)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在该反应中,还原剂是 。
(2)若在反应中生成了标况下2.24L氯气,则电子转移的个数是 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁盐、亚铁盐是实验室常用的药品。根据题意完成下列填空:
(1)若向硫酸亚铁溶液中滴加稀硝酸,可以看到溶液逐渐变黄。为检验最后溶液中是否还有亚铁离子剩余,可以_____________________________________________;向已酸化的FeCl3溶液中逐滴加入Na2S溶液,有浅黄色沉淀生成,溶液逐渐变为浅绿色。写出该反应的离子方程式 。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生。呈红色的物质是 (写化学式)。
已知:11H2O2+2SCN—→2SO42—+2CO2↑+ N2↑+10H2O +2H+若生成1mol N2,H2O2和SCN—的反应中转移电子物质的量是 mol。
(3)由以上实验,推断Fe2+、S2—和SCN—的还原性强弱 (按从强到弱顺序排列)。
(4)向FeCl3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4)。写出此过程的离子方程式、配平并标出电子转移的数目和方向 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列变化中起氧化作用和还原作用的元素不是同一种元素的是( )
| A.在400 ℃左右且有催化剂存在的条件下,用氨气把一氧化氮还原为氮气 |
| B.工业上用稀硫酸和氧气与单质铜反应制取硫酸铜 |
| C.工业上用石灰乳和氯气制备漂白粉 |
| D.实验室用氯酸钾和浓盐酸制取氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com