
【题目】已知0.1 molL-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是 ( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是 ( )
A. 通入少量HCl气体 B. 升高温度 C. 加少量冰醋酸 D. 加水
【答案】C
【解析】
A.通入少量HCl气体,增加了氢离子浓度,平衡左移,c(CH3COOH)增大,但是溶液中氢离子浓度增大程度更大,所以 c(H+)/c(CH3COOH)增大,故A错误;
B. 弱电解质的电离为吸热过程,升高温度醋酸的电离平衡向右移动,电离程度增大,则c(H+)/c(CH3COOH)值增大,故B错误;
C.加少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,醋酸的物质的量增大,则c(H+)/c(CH3COOH)值减小,故C正确;
D. 加水稀释,溶液体积增大,导致c(H+)和 c(CH3COOH)均减小,但是电离平衡CH3COOH![]() CH3COO-+H+正向移动,氢离子浓度减的少,醋酸浓度减的多,则 c(H+)/c(CH3COOH)的值增大,D错误;
CH3COO-+H+正向移动,氢离子浓度减的少,醋酸浓度减的多,则 c(H+)/c(CH3COOH)的值增大,D错误;
综上所述,本题选C。


科目:高中化学 来源: 题型:
【题目】在容积为10 L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
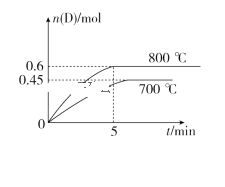
(1)800 ℃时,0~5 min内,以B表示的平均反应速率为________。
(2)能判断该反应达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)利用图中数据计算800 ℃时的平衡常数K=________,该反应为________反应(填“吸热”或“放热”)。
(4)700 ℃时,某时刻测得另一同体积密闭容器中各物质的量如下:n(A)=1.1 mol,n(B)=2.6 mol,n(C)=0.9 mol,n(D)=0.9 mol,则此时该反应________(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题:
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为_________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,2NO2(g)+N2(g)
4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,2NO2(g)+N2(g)![]() 4NO(g) ΔH=+293 kJ·mol-1,则反应CH4(g)+4NO(g)
4NO(g) ΔH=+293 kJ·mol-1,则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=_________kJ·mol-1。
2N2(g)+CO2(g)+2H2O(g)的ΔH=_________kJ·mol-1。
(3)800℃时,在刚性反应器中以投料比为1:1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 33.2 | 28.6 | 27.1 | 26.3 | 25.9 | 25.2 | 22.3 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52 min时,测得体系中p(O2)=11.4 kPa,则此时的p(NO)=_________kPa,v=_________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)_________(填“大于”“等于”或“小于”)22.3kPa,原因是___________________________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)![]() 2NO2(g),科研工作者提出如下反应历程:
2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)![]() 2NO2(g) 慢反应
2NO2(g) 慢反应
下列表述正确的是_________(填标号)。
A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效 D.第二步反应活化能较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,电离平衡常数K________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力最强的是______(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=CO32-+2HClO
(4)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。

则HX的电离平衡常数________(填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②用排饱和食盐水法收集Cl2
③高压比常压 有利于提高合成氨的产率
④高温下合成氨速率较快
⑤工业制取金属钾Na(l)+ KCl(l) ![]() NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
A. ②③⑤ B. ①②③⑤ C. ①②③④⑤ D. ②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com