
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136 kJ/mol
②C2H6(g)+ ![]() O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O(g) |
键能( kJ/mol) | 436 | X | 496 |
由此计算x=_________,通过比较△H1和△H2,说明和热裂解法相比,氧化裂解法的优点是_______________________________(任写一点)。
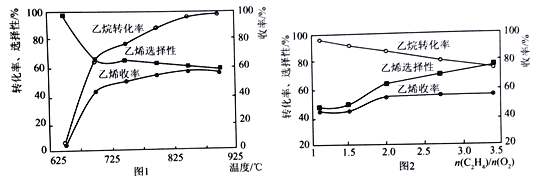
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是______,反应的最佳温度为____________(填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中n(C2H6)/n(O2)的最佳值是_______________,判断的理由是__________________________________。
(4)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___________________________。
反应达平衡时,各组分的体积分数如下表:
C2H6 | O2 | C2H4 | H2O | 其他物质 |
2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=_________(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
【答案】 465 氧化裂解反应是放热反应,节约能源;氧化裂解反应热力学趋势上大 温度升高,反应速率加快,转化率升高 C 2 比值小于2时,乙烯的收率降低;比值大于2时,乙烯的收率并未增加且产生更多的积炭,堵塞反应管 正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动 KP = 75![]()
【解析】(1)②-①:![]() O2(g)+ H2(g) = H2O(g) ΔH=-246 kJ/mol,H-H(g)= 436 kJ/mol, H-O(g)= X
O2(g)+ H2(g) = H2O(g) ΔH=-246 kJ/mol,H-H(g)= 436 kJ/mol, H-O(g)= X
O=O(g)= 496 kJ/mol由此计算x= 465 kJ/mol,
通过比较△H1和△H2,说明和热裂解法相比,氧化裂解法的优点是氧化裂解反应是放热反应,节约能源;氧化裂解反应热力学趋势上大。
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物,因为副反应均为放热反应升高温度,不利于副产物的生成;因为乙烯选择性=![]() ,所以由图知温度升高,反应速率加快,转化率升高为;由图观察温度在850℃和900℃之间,乙烷的转化率都比较大,乙烯收率较高和乙烯选择性较,所以,选择850℃较好,答案:温度升高,反应速率加快,转化率升高 C。
,所以由图知温度升高,反应速率加快,转化率升高为;由图观察温度在850℃和900℃之间,乙烷的转化率都比较大,乙烯收率较高和乙烯选择性较,所以,选择850℃较好,答案:温度升高,反应速率加快,转化率升高 C。
(3)由图2观察知n(C2H6)/n(O2)<2时,乙烯的收率降低;比值大于2时,乙烯的收率并未增加且产生更多的积炭,堵塞反应管,所以当n(C2H6)/n(O2)=2时最佳值。答案2 比值小于2时,乙烯的收率降低;比值大于2时,乙烯的收率并未增加且产生更多的积炭,堵塞反应管。
(4)由C2H6(g)+ ![]() O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol,知正反应是气体分子数增多的反应,工业上,保持体系总压恒定为100kPa的条件下进行该反应,如果在乙烷和氧气的混合气体中掺混惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动,提高反应物的转化率。
O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol,知正反应是气体分子数增多的反应,工业上,保持体系总压恒定为100kPa的条件下进行该反应,如果在乙烷和氧气的混合气体中掺混惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动,提高反应物的转化率。
因为总压恒定为100kPa,
C2H6(g) +![]() O2(g) = C2H4(g)+ H2O(g)
O2(g) = C2H4(g)+ H2O(g)
平衡量2.4%![]() 1.0%
1.0%![]() 12%
12%![]() 15%
15%![]() kPa
kPa
该温度下的平衡常数就是反应达到平衡时Kp=生成物浓度幂次方的乘积比反应物浓度幂次方的乘积,所以Kp=![]() =75
=75![]()
答案:正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动,75![]()


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.![]() B.
B.![]() C.
C.![]() D.CH2 = CH—CH = CH2E.环戊烷
D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)用系统命名法对B进行命名____________________________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B发生加聚反应的化学方程式为 ____________________________________。
(5)如图表示的是一种叫做双烯合成的有机反应,请写出B与D发生双烯合成所得产物的结构简式__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是 )
A. cOH)=cH+)的溶液 B. 盐溶液
C. pH=3的酸与pH=11的碱等体积混合所得溶液 D. pH=7的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:

请回答:
(1) X 的化学式是______。
(2) 固体甲与稀硫酸反应的离子方程式是______。
(3) 写出 X 在隔绝空气高温反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol(Lmin)﹣1
B.分别用B,C,D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol(Lmin)﹣1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是( )
A. CH4+Cl2![]() CH3Cl + HCl
CH3Cl + HCl
B. H2+ Cl2![]() 2HCl
2HCl
C. CH2=CH2+ H2O![]() CH3CH2OH
CH3CH2OH
D. 2NaOH + Cl2=NaClO + NaCl + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇: 反应I:CO(g)+2H2(g)CH3OH(g)△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H10 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为 , 此时的温度为(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是 .
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式: .
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题: 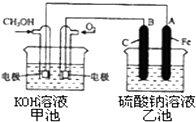
①通入甲醇蒸气的电极应为极(填写“正”或“负”),该电极上发生的电极反应是(填字母代号).
a.2CH3OH﹣12e﹣+3O2═2CO2+4H2O
b.CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
c.O2+2H2O+4e﹣═4OH﹣
d.O2﹣4e﹣+4H+═2H2O
②写出电极A的名称 . 写出B电极的电极反应式 .
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO 的制备原理:HCOOH ![]() CO↑+H2O。
CO↑+H2O。
(1)正丁醛经催化加氢得到含少量正丁醛的 1-丁醇粗品。为纯化 1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) →RCH(OH)SO3Na↓;
②沸点:乙醚 34℃,1-丁醇 118℃,并设计出如下提纯路线:
![]()
试剂1为 ,操作3为 。
(2)原料气CH3CH=CH2、CO和H2的制备装置图设计如下:
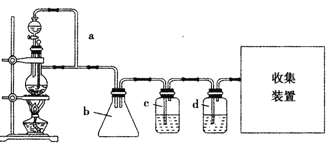
填写下列空白:
①若用上述装置制备干燥纯净的CO气体,装置b的作用是 ;c中盛装的试剂是 。
②若用上述装置制备氢气,收集装置可选用下列装置
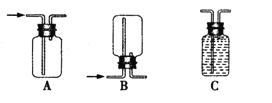
③实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯,写出反应的化学方程式: 。 制丙烯时,产生的气体除了丙烯及水蒸气外,还存在CO2、SO2;为检验这四种气体,下列装置按气流方向的连接顺序为 。
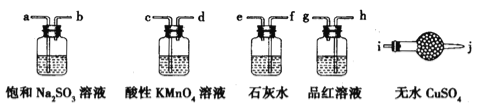
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com