
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:分析 (1)3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4中,只有O元素的化合价降低,利用化合价计算转移电子;
(2)AlCl3为强酸弱碱盐,铝离子水解导致溶液呈酸性;
(3)①电解池的阴极连接电源的负极,根据电解产物判断;
②阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③根据电极方程式计算,有关反应有为阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
(4)利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
解答 解:(1)3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4中,有1.5mol FeS2参加反应,4mol氧气参加反应,只有O元素的化合价降低,则转移电子为4mol×2×[0-(-2)]=16mol,
故答案为:16;
(2)AlCl3为强酸弱碱盐,铝离子水解导致溶液呈酸性,水解方程式为Al3++3H2O?Al(OH)3+3H+;故答案为:Al3++3H2O?Al(OH)3+3H+;
(3)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律及本题图中的电极产物H2和Cl2,可以判断出A为电源的正极,B为电源的负极,故答案为:B;
②阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,
故答案为:2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的6.72 L气体中,V(N2)=V(CO2)=$\frac{6.72}{5}$L=1.344L,
即n(N2)=n(CO2)=0.06 mol,根据方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知生成0.06mol N2所消耗的CO(NH2)2的物质的量也为0.06 mol,其质量为:m[CO(NH2)2]=0.06mol×60 g•mol-1=3.6 g,
故答案为:不变;3.6;
(4)已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ•moL-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ•moL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ•moL-1-(-483.6KJ•moL-1)=-82.4KJ•moL-1.
即CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1.
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1.
点评 本题考查了盖斯定律及其电解原理知识,包括电极产物的判断、电解原理及其应用等,解答电解原理试题时,首先要注意阳极材料,若阳极材料为除Au、Pt之外的金属,则阳极金属先失去电子,若阳极材料为惰性电极,则考虑阴离子的放电顺序,熟记阴阳离子的放电顺序是解题的关键.


科目:高中化学 来源: 题型:选择题
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
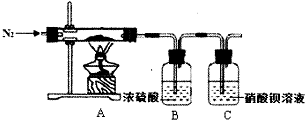 硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.
硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C消耗的速率与A消耗的速率相等 | |
| B. | 单位时间内生成a mol B,同时消耗a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHCO3和MgCO3 | B. | K2CO3和Na2CO3 | C. | MgCO3和Na2CO3 | D. | KHCO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中露置会立刻被空气氧化成过氧化钠 | |
| B. | 钠单质具有强还原性,可将铜从其盐溶液中置换出来 | |
| C. | 钠与钠离子都具有强的还原性 | |
| D. | 钠与稀盐酸反应的实质是与氢离子的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
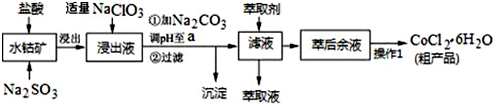
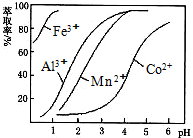
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
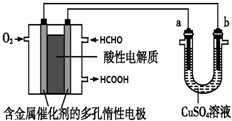
| A. | 当a、b都是铜做电极时,电解的总反应方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑ | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4 OH- | |
| C. | 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- | |
| D. | 燃料电池工作时,负极反应为:HCHO+H2O-2e-═HCOOH+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15 | B. | 16 | C. | 17 | D. | 18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com