
如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05mol•L﹣1的CuCl2溶液,B池中加入0.1mol•L﹣1的AgNO3溶液,进行电解.a、b、c、d四个电极上所析出的物质的物质的量之比是()
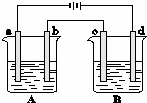
A. 1:1:2:1 B. 2:1:1:1 C. 2:2:4:1 D. 2:1:2:1
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: 根据电解方程式:A池中,阳极电极反应式为:2Cl﹣﹣2e﹣=Cl2↑,阴极电极反应式为:Cu2++2e﹣=Cu;B池中电极方程式为,4AgNO3+2H2O Ag↓+4HNO3+O2↑,阳极发生4OH﹣﹣4e﹣=2H2O+O2↑,阴极Ag++e﹣=Ag,据电子守恒分析.
Ag↓+4HNO3+O2↑,阳极发生4OH﹣﹣4e﹣=2H2O+O2↑,阴极Ag++e﹣=Ag,据电子守恒分析.
解答: 解:根据电解方程式:A池中,阳极电极反应式为:2Cl﹣﹣2e﹣=Cl2↑,阴极电极反应式为:Cu2++2e﹣=Cu;B池中电极方程式为,4AgNO3+2H2O Ag↓+4HNO3+O2↑,阳极发生4OH﹣﹣4e﹣=2H2O+O2↑,阴极Ag++e﹣=Ag,据电子守恒,假设转移4mol电子,A池中阳极b生成2mol氯气,阴极a生成2molCu,B池中阳极d生成1mol氧气,阴极c生成4molAg,所以a、b、c、d四个电极上所析出的物质的物质的量之比是2:2:4:1,故选C.
Ag↓+4HNO3+O2↑,阳极发生4OH﹣﹣4e﹣=2H2O+O2↑,阴极Ag++e﹣=Ag,据电子守恒,假设转移4mol电子,A池中阳极b生成2mol氯气,阴极a生成2molCu,B池中阳极d生成1mol氧气,阴极c生成4molAg,所以a、b、c、d四个电极上所析出的物质的物质的量之比是2:2:4:1,故选C.
点评: 本题考查学生电解池的工作原理以及电池反应的应用和计算,难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
下列各组离子在无色溶液屮可以大最共存的是( )
A. NH4+、NO3﹣、OH﹣ B. Ca2+、OH﹣、HCO3﹣
C. Na+、S2﹣、Cl﹣ D. Fe3+、Na+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用电化学原理解释的是()
A. 轮船水线下的船体上装一定数量的锌块
B. 镀锌铁比镀锡铁耐用
C. 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大
D. 铝片不用特殊方法保护
查看答案和解析>>
科目:高中化学 来源: 题型:
在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时()
A. c(Ba2+)=c(SO42﹣)
B. c(Ba2+)≠c(SO42﹣),c(Ba2+)•c(SO42﹣)=Ksp(BaSO4)
C. c(Ba2+)=c(SO42﹣)=[Ksp(BaSO4)]1/2
D. c(Ba2+)≠c(SO42﹣),c(Ba2+)•c(SO42﹣)≠Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
将a mol•L﹣1的Na2CO3溶液与b mol•L﹣1的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断不正确的是()
A. c(Na+)+c(H+)>c(CO32﹣)+c(HCO3﹣)+c(OH﹣)
B. c(Na+)>c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
C. 若c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),则一定a<b
D. 若a=b,则溶液中c(HCO3﹣)>c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是()
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B. 2 L 0.5 mol•L﹣1硫酸钾溶液中阴离子所带电荷数为NA
C. 1 mol Na2O2固体中含离子总数为4NA
D. 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某未知溶液可能含Cl﹣、CO32﹣、Na+、SO42﹣、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红.取少量试液,加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀.下列判断合理的是()
A. 一定有Cl﹣ B. 一定有SO42﹣ C. 一定没有Al3+ D. 一定有CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏伽德罗常数的数值为NA,下列说法正确的是()
A. 1.8g NH4+含有的电子数为NA
B. 1mol Cl2与足量Fe反应,转移的电子数为3NA
C. 46g的NO2与46g的N2O4含有的原子数不同
D. 标准状况下11.2L苯完全燃烧产生二氧化碳分子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com