
| A. | 向该溶液中加入pH=3的盐酸溶液,溶液的pH值减小 | |
| B. | 向该溶液中加入蒸馏水,CH3COOH和水的电离程度均增加 | |
| C. | CH3COOH(aq)?CH3COO-(aq)+H+(aq),Ka=1.0×10-5 | |
| D. | 0.1mol/L的CH3COONa溶液,溶液的pH=9 |
分析 A.等PH的酸溶液混合溶液PH不变;
B.醋酸为弱电解质,加水促进电离,氢离子浓度减小水的抑制程度减小;
C.电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$;
D.0.1mol/L的CH3COONa溶液,溶液中醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,水解平衡常数K=$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$.
解答 解:A.窒温下,0.1mol/L的CH3COOH溶液pH=3,该溶液中加入pH=3的盐酸溶液,溶液的pH值不变,故A错误;
B.向该溶液中加入蒸馏水,促进CH3COOH电离,氢离子浓度减小,水的电离程度增加,故B正确;
C.CH3COOH(aq)?CH3COO-(aq)+H+(aq),Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{(1{0}^{-3})^{2}}{0.1}$=1.0×10-5,故C正确;
D.CH3COO-+H2O?CH3COOH+OH-,水解平衡常数K=$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9,故D正确;
故选A.
点评 本题考查了弱电解质电离平衡的影响因素、电离平衡常数的计算、盐类水解应用,掌握基础是解题关键,题目难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
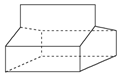 按要求回答问题:
按要求回答问题: ;
;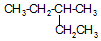 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
. ,如果要合成
,如果要合成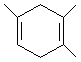 ,所用的原料可以是
,所用的原料可以是 查看答案和解析>>
科目:高中化学 来源: 题型:实验题
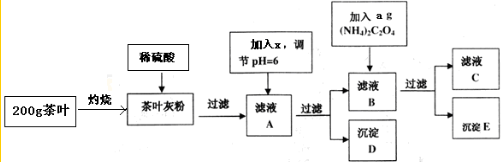
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
| 编号 | 终点时消耗KMnO4溶液体积(mL) |
| 1 | 19.98 |
| 2 | 22.00 |
| 3 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
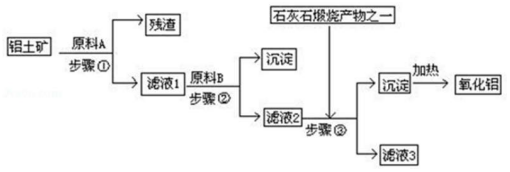
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com