
| 测定序号 | NaHCO3溶液的体积/mL | 盐酸标准液滴定管中的读数/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 1.50 | 21.52 |
| 2 | 20.00 | 1.80 | 25.62 |
| 3 | 20.00 | 0.20 | 20.18 |
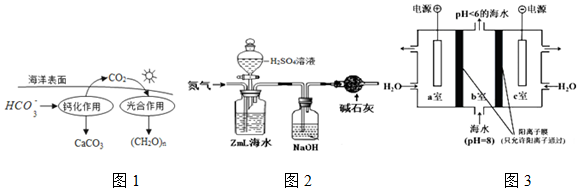
分析 (1)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度不再变化,据此进行判断;
(2)由图可知:此过程碳酸氢根转化生成碳酸钙,据此书写方程式;
(3)①氢氧化钠溶液用于吸收二氧化碳,为了排除空气中二氧化碳的干扰,需要用盛有碱石灰的干燥管;
②发生反应为NaHCO3+HCl=NaCl+CO2↑+H2O,碳酸氢钠与HCl的物质的量相等,先计算出消耗盐酸的体积,排除无效数据后计算出消耗盐酸的平均体积,再根据n=cV计算出HCl的物质的量,从而可知碳酸氢钠的物质的量,最后根据碳元素守恒及c=$\frac{n}{V}$计算海水中溶解的无机碳的浓度;
(4)a室接电源的正极,为阳极,水失去电子生成氧气和氢离子,氢离子通过阳离子交换膜进入b室,与b室中的碳酸氢根反应生成二氧化碳气体,据此解答即可.
解答 解:(1)A.根据质量守恒可知混合体系中的碳总量始终保持不变,无法据此判断平衡状态,故A错误;
B.混合液的pH保持不变,表明各组分的浓度不再变化,已经达到平衡状态,故B正确;
C.HCO3-与H2CO3的浓度相等,无法判断二者浓度是否不变,则无法判断是否达到平衡状态,故C错误;
D.HCO3-的百分含量保持不变,表明正逆反应速率相等,各组分浓度不再变化,已经达到平衡状态,故D正确;
故答案为:BD;
(2)反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O,
故答案为:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O;
(3)①根据图示可知,空气中二氧化碳能够与氢氧化钠溶液反应,干扰了检验结果,为了防止空气中的二氧化碳进入被氢氧化钠溶液吸收,需要用盛有碱石灰的干燥管,
故答案为:防止空气中的二氧化碳进入被氢氧化钠溶液吸收;
②第一次滴定消耗盐酸体积为:21.52mL-1.50mL=20.02mL,
第二次滴定消耗盐酸体积为:25.62mL-1.80mL=23.82mL(舍弃),
第三次滴定消耗盐酸体积为:20.18mL-0.20mL=19.98mL,
第二次滴定误差较大,为无效数据,则其它两次滴定消耗盐酸评价体积为:$\frac{20.02mL+19.98mL}{2}$=20.00mL,每次滴定消耗HCl的物质的量为:ymol/L×0.02L=0.02ymol,
根据反应原理NaHCO3+HCl=NaCl+CO2↑+H2O可知,20.00mLNaHCO3溶液中含有碳酸氢钠的物质的量为:n(NaHCO3)=n(HCl)=0.02ymol,200mL的NaHCO3溶液中含有碳酸氢钠的物质的量为:0.02ymol×$\frac{200mL}{20mL}$=0.2ymol,
根据C元素守恒可知Z mL海水中的无机碳的物质的量为0.2ymol,
所以海水中溶解的无机碳的浓度为:$\frac{0.2ymol}{Z×1{0}^{-3}L}$=$\frac{200y}{Z}$mol/L,
故答案为:$\frac{200y}{Z}$;
(4)提取CO2的原理为:a室连接电源正极,为电解池的阳极,b室为阴极,阳极发生氧化反应,发生反应为:2H2O-4e-=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应为:H++HCO3-=CO2↑+H2O,
故答案为:a室:2H2O-4e=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O.
点评 本题考查较为综合,涉及中和滴定、化学平衡状态判断、电解原理、离子方程式书写等知识,明确中和滴定原理为解答关键,注意掌握电解原理,试题培养了学生的分析、理解能力及灵活应用能力.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 23g乙醇含有碳氢键数为3NA | |
| B. | 标准状况下,2.24L SO3含有的分子数为0.1NA | |
| C. | 1mol 过氧化氢完全分解,电子转移数为1NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
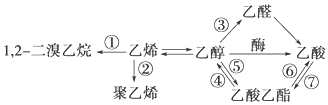
| A. | 反应①是加成反应 | B. | 只有反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应③是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 25.0 | 24.5 | 24.75 | 29.3 | 4.55 |
| 2 | 24.5 | 24.2 | 24.35 | 28.3 | 3.95 |
| 3 | 25.0 | 24.5 | 24.75 | 28.7 | 3.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O是淡黄色固体,和水反应生成NaOH,是碱性氧化物 | |
| B. | 钠应保存于煤油中 | |
| C. | 钠投入滴有紫色石蕊试液的水中,溶液呈现红色 | |
| D. | 钠的焰色为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
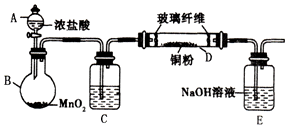 实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去).
实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com