
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
分析 中学常见既能与酸又能与碱反应的物质有:铝、两性氧化物、两性氢氧化物、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等.
解答 解:①NH4HCO3与氢氧化钠反应生成碳酸钠和氨气、水,与盐酸反应生成氯化铵、二氧化碳和水,故选;
②硫酸钠与氢氧化钠、盐酸都不反应,故不选;
③Al2O3为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,与盐酸反应生成氯化铝和水,故选;
④Al(OH)3 为两性氢氧化物,与氢氧化钠反应生成偏铝酸钠和水,与盐酸反应生成氯化铝和水,故选;
⑤Al与盐酸反应生成氯化铝和氢气,与氢氧化钠反应生成偏铝酸钠和氢气,故选;
故选:A.
点评 本题考查元素化合物性质,掌握物质的性质是关键,侧重对基础知识的巩固,注意归纳总结中学常见能与酸、碱反应的物质,注意两性物质的性质.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
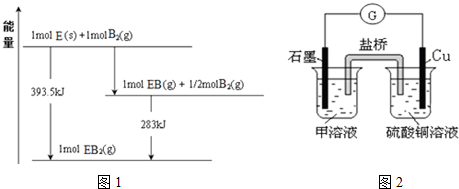
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇 | B. | 甲酸 | C. | 甲醛 | D. | 甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应,有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
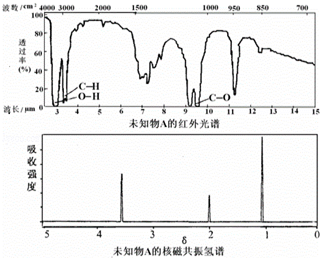
| A. | 由红光外谱可知,该有机物中有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有两种不同化学环境的氢原子 | |
| C. | 仅由核磁共振氢谱即可得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压缩容器体积,增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应所需的活化能,活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
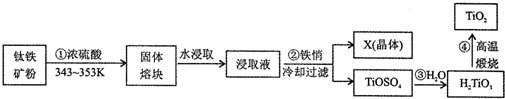
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
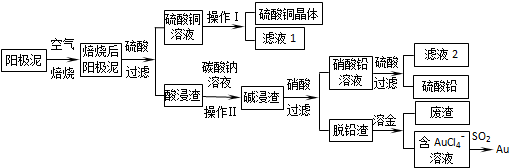
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | 碱金属元素是指ⅠA族的所有元素 | |
| D. | 副族元素中没有非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com