
科目:高中化学 来源: 题型:
| A、硝酸钠晶体 |
| B、豆浆 |
| C、Fe (OH)3胶体 |
| D、75%的酒精溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2KClO3
| ||||
B、3CO+Fe2O3
| ||||
C、3Mg+2NH3
| ||||
| D、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
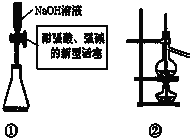
| A、装置①量取15.00 mLNaOH溶液 |
| B、装置②既可用于乙醇制乙烯的发生装置,又可用于分离沸点相差较大的互溶液体混合物 |
| C、室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色 |
| D、纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 阅读材料,选择合适的方法把下列混合物按要求分离.
阅读材料,选择合适的方法把下列混合物按要求分离.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以 任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、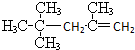 的名称为2,2,4-三甲基戊烯 的名称为2,2,4-三甲基戊烯 |
B、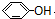 、 、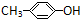 和 和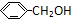 互为同系物 互为同系物 |
| C、CH≡CCH2CH3的所有碳原子在一条直线上 |
D、HCHO和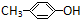 在一定条件下能发生缩聚反应生成 在一定条件下能发生缩聚反应生成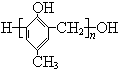 |
查看答案和解析>>
科目:高中化学 来源: 题型:
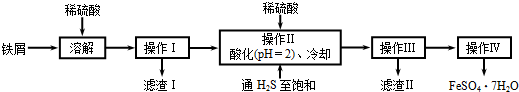
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com