
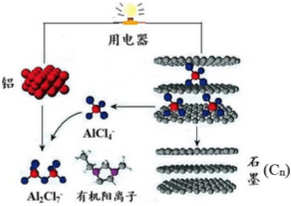
 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- | |
| D. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 |
分析 A、放电时,铝是活泼的金属铝是负极,不活泼石墨为正极;
B、原电池中阳离子向正极移动;
C、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-;
D、阳极性氧化反应.
解答 解:A、放电时,铝是活泼的金属铝是负极,不活泼石墨为正极,故A正确;
B、原电池中阳离子向正极移动,所以有机阳离子向石墨电极方向移动,故B错误;
C、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,故C正确;
D、阳极性氧化反应,电极反应式为:Cn+AlCl4--e-═CnAlCl4,故D正确;
故选B.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)减小 | B. | pH的变化值等于2 | ||
| C. | 溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | D. | Kw的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 钠加入水中:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜片放入浓HNO3溶液中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的实验式 C3H6 | |
| B. | 镁离子的结构示意图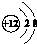 | |
| C. | CO2的电子式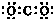 | |
| D. | 中子数为18的氯原子符号${\;}_{17}^{18}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和澄清石灰水反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 实验室用大理石和稀醋酸制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com