
分析 (1)用短线“-”代替共用电子对即为结构式,结构式只把共用电子对用短线表示,未成键的电子不画出;
(2)硫酸氢铵为强电解质,在溶液中完全电离出铵根离子、氢离子和硫酸根离子;
(3)亚硫酸为二元弱酸,分步电离,主要以第一步为主,据此写出其电离方程式;
(4)氢氧化钙与稀盐酸反应生成氯化钙和水,氢氧化钙需要拆开;
(5)二氧化硫与溴发生氧化还原反应,导致溴水褪色;
(6)实验室检验某盐溶液中是否含有NH4+的常用方法是:向该溶液中加入浓Na0H溶液,加热,然后用某种试纸检验产生的气体,该气体为氨气,是铵根离子和氢氧根离子反应生成的氨气.
解答 解:(1)氮气分子中含有氮氮三键,N2的结构式为N≡N,
故答案为:N≡N;
(2)NH4HSO4是强电解质,在水溶液里完全电离生成氢离子、铵根离子和硫酸根离子,其电离方程式为:NH4HSO4=NH4++H++SO42-,
故答案为:NH4HSO4=NH4++H++SO42-;
(3)亚硫酸是多元弱酸分步电离,主要以第一步为主,其电离离子方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-,
故答案为:H2SO3?H++HSO3-、HSO3-?H++SO32-;
(4)澄清石灰水中的氢氧化钙需要拆开,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(5)二氧化硫具有还原性,能被溴水氧化,溴水褪色,反应的离子方程式为:SO2+Br2+2H2O=4H++SO42-+2Br-,
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;
(6)向该溶液中加入浓Na0H溶液,加热,然后用某种试纸检验产生的气体,该气体为氨气,该反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查较为综合,涉及结构式、电离方程式、离子方程式的书写,题目难度中等,明确发生反应实质为解答关键,注意掌握离子方程式、电离方程式的书写原则,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | Cl-、Br-、S2- | B. | Br-、Cl-、S2- | C. | S2-、Br-、Cl- | D. | Br-、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
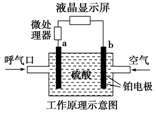 酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )| A. | b为正极,电极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解质溶液中的H+移向a电极 | |
| C. | 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 | |
| D. | 呼出气体中酒精含量越高,微处理器中通过的电流越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NaHCO3与足量盐酸反应放出CO2气体的体积为22.4L | |
| B. | 1 mol Al3+离子含有的核外电子数为3NA | |
| C. | O2和O3的混合气体,质量为48g,所含氧原子数为3NA | |
| D. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2的分子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②①⑤④ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验自来水中是否含有氯离子 | B. | 检验土豆中是否含有淀粉 | ||
| C. | 检验鸡蛋中是否含有碳酸钙 | D. | 检验无水酒精中是否含水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液X中一定含有Na+、Cl-和SiO32- | |
| B. | 溶液X中一定不含Ca2+、Br- | |
| C. | 为确定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液 | |
| D. | 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭 | |
| B. | 工业上电解熔融的MgCl2制Mg,推测:工业上电解熔融的AlCl3制Al | |
| C. | Fe与CuCl2溶液反应可以置换出Cu,推测:钠与CuCl2溶液反应也可以置换出Cu | |
| D. | Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,推测:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com