
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为_____kJ.
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=_____mol/L。
若加入少量NaOH固体,则溶液中![]() _____(填"增大”、“减小”或“不变”)。
_____(填"增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32- ____(填“能”或“不能”)大量共存。
②pH=12时,Na2CO3溶液中物料守恒关系为______。当pH=7时,溶液中含碳元素的微粒主要为_________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=_____。
HCO3-+OH-的平衡常数Kh=_____。
【答案】 631.5 10-9 不变 不能 c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) HCO3- 10-4
【解析】(1)旧键断裂吸收的能量减去新键生成释放的能量值即为化学反应所吸收的能量,结合N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol,N2(g)+O2(g)=2NO(g) H=+180.0kJ/moL,可以计算NO分子中化学键的键能;
(2)溶液中pH=-lgc(H+),CH3COOH为酸,水电离出的c(H+)等于溶液中溶液中的c(OH-);往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中![]() =
=![]() ,温度不变电离平衡常数不变,溶液中存在电荷守恒;
,温度不变电离平衡常数不变,溶液中存在电荷守恒;
(3)常温下在Na2CO3溶液中逐滴加入稀盐酸,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①根据图2可以知道,pH=8时只有碳酸氢根离子,pH大于8时存在碳酸根离子和碳酸氢根离子离子,pH小于8时存在碳酸和碳酸氢根离子,在同一溶液中,H2CO3、HCO3-、CO32-不能共存;
②Na2CO3溶液中物料守恒关系,即Na原子是C原子的2倍,以此分析;pH=7时,溶液中溶质为碳酸氢钠、氯化钠及碳酸,存在的离子主要为:HCO3-;
③当溶液中c(HCO3-):c(CO32-)=1:1时,图象可以知道pH=10,c(H+)=10-10mol/L,由Kw可以知道c(OH-)=10-4 mol/L,据此计算水解平衡常数。
(1)根据N2、O2分子中化学键的键能分别是946kJmol-1、497kJmol-1以及反应N2(g)+O2(g)=2NO(g) △H=+180kJmol-1可设NO分子中化学键的键能为X,则有:946kJmol-1+497kJmol-1-2X=180kJmol-1得:X=631.5kJmol-1,故答案为:631.5;
(2)CH3COOH为酸,pH=-lgc(H+),pH等于5的CH3COOH溶液中C(H+)=1.0×10-5mol/L,25℃时:Kw=c(OH-)×c(H+)=10-14,溶液中的c(OH-)=![]() =1.0×10-9mol/L,pH等于5的CH3COOH溶液中氢离子来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的C(H+)是1.0×10-9mol/L,往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中
=1.0×10-9mol/L,pH等于5的CH3COOH溶液中氢离子来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的C(H+)是1.0×10-9mol/L,往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中![]() =
=![]() 温度不变电离平衡常数不变,故答案为:1.0×10-9mol/L;不变;
温度不变电离平衡常数不变,故答案为:1.0×10-9mol/L;不变;
(3)常温下在Na2CO3溶液中逐滴加入稀溶液,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水。
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故答案为:不能;
②Na2CO3溶液中物料守恒关系,即Na原子是C原子的2倍,因此有:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);由图象可知,pH=7时,c(OH-)=c(H+),溶液中含碳元素的主要微粒为HCO3-、H2CO3(少量),故答案为:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);HCO3-;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界中不存在的P的一种同位素——![]() P,开创了人造核素的先河:
P,开创了人造核素的先河:![]() Al+
Al+![]() He→
He→![]() P+
P+![]() n。下列有关说法不正确的是( )
n。下列有关说法不正确的是( )
A. 该变化说明原子核在化学反应中也能发生变化
B. 该变化遵循质量守恒定律
C. ![]() n是一种电中性粒子
n是一种电中性粒子
D. 对于30P:原子序数=质子数=中子数=核外电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2 (g)+ O2(g) ![]() 2SO3(g) ΔH,有关数据如下:
2SO3(g) ΔH,有关数据如下:
T(℃) | 527 | 627 | 727 | 827 | 927 |
平衡常数K | 910 | 42 | 3.2 | 0.39 | 0.12 |
下列说法不正确的是
A. 根据平衡常数随温度的变化关系,判断出ΔH<0
B. 保持其他条件不变,SO2的平衡转化率α(727℃)<α(927℃)
C. 增大压强、降低温度能提高SO2的转化率
D. SO3的稳定性随温度的升高而降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A. △H=+244.1 kJ·mol-1B. △H=-488.3 kJ·mol-1
C. △H=-996.6 kJ·mol-1D. △H=+996.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫酸的叙述中正确的是( )
A.浓硫酸、稀硫酸都难挥发
B.浓硫酸、稀硫酸都能氧化金属锌,且反应实质相同
C.浓硫酸、稀硫酸在加热时都能与铜反应
D.浓硫酸、稀硫酸在常温下都能用铁制容器贮存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的。请回答下列问题:

(1)描述D在元素周期表中的位置:_____________________________。
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是__________(写化学式,下同),非金属最简单气态氢化物最不稳定的是_____________________。
(3)写出满足下列条件分子的结构式_________________________
①所有原子最外层是8个电子; ②C和E组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,其可以用来合成氮肥,某氮肥厂氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:

请回答下列问题:
(1)过程1中加入氢氧化钠,写出其中发生的离子方程式____________________
(2)写出氨分子的结构式______;指出分子中化学键是_____(填‘离子键’或‘共价键’)。
(3)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。其中第一步反应的能量变化示意图如图:
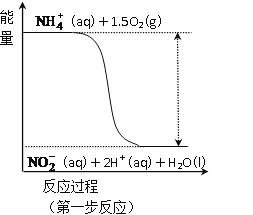
第一步反应是_______反应(选填“放热”或“吸热”),判断依据是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示:
2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示:


下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度,40 min时升高温度
D. 30 min时减小压强,40 min时升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com