
 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子. ,分子中有2个σ键,2个π键.
,分子中有2个σ键,2个π键.分析 A、B、C、D为前四周期元素,B元素的最外层电子数是其电子层数的3倍,最外层电子数不超过8个,所以该元素为O元素,C元素原子的M电子层的P亚层中有3个未成对电子,则C是P元素,D元素原子核外的N层中只有2对成对电子,则D的核外电子排布式为:1s22s22p63s23p4,则D是S元素,据此答题.
解答 解:A、B、C、D为前四周期元素,B元素的最外层电子数是其电子层数的3倍,最外层电子数不超过8个,所以该元素为O元素,C元素原子的M电子层的P亚层中有3个未成对电子,则C是P元素,D元素原子核外的N层中只有2对成对电子,则D的核外电子排布式为:1s22s22p63s23p4,则D是S元素,
(1)当n=2时,A元素的原子价电子排布为ns2np2,则A为C元素,AB2为CO2,其电子式为 ,二氧化碳中碳氧之间是双键,其中有一个是σ键,一个是π键,所以每个二氧化学碳中含有2个σ键和2个π键,
,二氧化碳中碳氧之间是双键,其中有一个是σ键,一个是π键,所以每个二氧化学碳中含有2个σ键和2个π键,
故答案为: ;
;
(2)当n=3时,A元素的原子价电子排布为ns2np2,则A为Si元素,A单质形成的晶体属于原子晶体,
故答案为:原子;
(3)若A元素的原子价电子排布为3s23p2,则A为Si元素,同周期元素从左向右,第一电离能增大,但Si、P、S三种元素中,由于P元素的最外层电子处于半满状态,是一种稳定结构,其第一电离能高于同周期相邻的元素,所以Si、P、S的第一电离能由大到小的顺序是P>S>Si,
故答案为:P>S>Si;
(4)钴离子的化合价是+3价,钴离子核外有24个电子,其基态时核外电子排布式为1s22s22p63s23p63d6,
故答案为:1s22s22p63s23p63d6 (或[Ar]3d6);
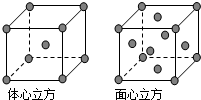
(5)体心立方晶胞中含有Fe原子的个数为8×$\frac{1}{8}$+1=2,面心立方晶胞中实际含有的Fe原子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2,
故答案为:1:2.
点评 本题考查了元素的推断、电离能大小的判断、核外电子排布式的书写、晶胞计算等,注意书写基态原子核外电子排布式时要根据构造原理,注意计算晶胞时要有一定的思维能力、空间想象能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
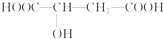 苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸是这种饮料的主要酸性物质,苹果酸的结构简式如图.下列说法正确的是( )
苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸是这种饮料的主要酸性物质,苹果酸的结构简式如图.下列说法正确的是( )| A. | 苹果酸不能使紫色石蕊试液变红 | |
| B. | 苹果酸分子间能发生酯化反应 | |
| C. | 1mol 苹果酸能与 2molNa 发生反应 | |
| D. | 1mol 苹果酸与 NaHCO3溶液反应最多消耗3mol NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2:sp2、直线形 | B. | SO42-:sp3、三角锥形 | ||
| C. | H3O+:sp3、V形 | D. | BF3:sp2、平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(H2CO3)+c(HCO3-) | B. | 2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| B. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| C. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| D. | 聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2一定是分子晶体 | B. | XY2的电子式可能是 | ||
| C. | XY2水溶液不可能呈碱性 | D. | X可能是ⅣA、ⅤA或ⅥA族元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com