
(14分)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,
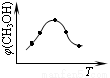
则上述CO2转化为甲醇的反应的△H3__________0(填“>”、“<”或“=”)。
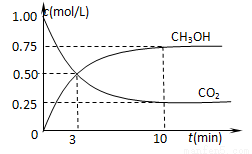
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。试回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);该温度下,反应的平衡常数的值为 ;第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数 (填变大、减少、不变)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其原因用离子方程式表示为 ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+) + c(H+)__________c(NO3-) + c(OH-)(填写 “>”“=”或“<”)
(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol(2分)
(2)①< (2分) ②0.225 (2分) ,16/3 (2分),变大(2分)
(3)NH4++H2O  NH3·H2O+H+ (2分) , <(2分)
NH3·H2O+H+ (2分) , <(2分)
【解析】
试题分析:(1)将两式相加,整理可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;(2)①根据图像可知:在一定的温度范围内,温度越高,反应速率越快,在相同的时间内产生的甲醇就越多,当温度升高到一定温度后随着反应温度的升高,甲醇的含量反而降低,是因为当反应达到平衡后,升高温度,平衡向逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,故△H3<0;②0~10 min内,V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),V(H2)=3 V(CO2)= 3×0.075mol/(L·min)=0.225 mol/(L·min);该温度下,反应达到平衡时各种物质的浓度分别是:C(CO2)=0.25mol/L;C(H2)=0.75mol/L;C(CH3OH)=0.75mol/L;C(H2O)= 0.75mol/L。所以反应的平衡常数的值为K=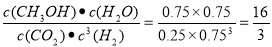 第10 min后,向该容器中再充入1 mol CO2和3 mol H2,由于该反应是在恒容条件下进行,正反应是气体体积减小的反应,所以增大压强,平衡正向移动,因此当再次达到平衡时CH3OH(g)的体积分数将增大;(3)硫酸铵和硝酸铵的水溶液的pH<7,其原因是盐是强酸弱碱盐,NH4+发生水解反应消耗水电离产生的OH-,最终使溶液中c(H+)>c(OH-)。用离子方程式表示为NH4++H2O
第10 min后,向该容器中再充入1 mol CO2和3 mol H2,由于该反应是在恒容条件下进行,正反应是气体体积减小的反应,所以增大压强,平衡正向移动,因此当再次达到平衡时CH3OH(g)的体积分数将增大;(3)硫酸铵和硝酸铵的水溶液的pH<7,其原因是盐是强酸弱碱盐,NH4+发生水解反应消耗水电离产生的OH-,最终使溶液中c(H+)>c(OH-)。用离子方程式表示为NH4++H2O  NH3·H2O+H+。在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则根据电荷守恒,c(NH4+) +c(Na+) + c(H+)=c(NO3-) + c(OH-),所以溶液中c(Na+) + c(H+)<c(NO3-) + c(OH-)。
NH3·H2O+H+。在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则根据电荷守恒,c(NH4+) +c(Na+) + c(H+)=c(NO3-) + c(OH-),所以溶液中c(Na+) + c(H+)<c(NO3-) + c(OH-)。
考点:考查盖斯定律的应用、反应热的判断、平衡常数的计算、化学反应速率的计算、微粒浓度的比较。


科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在 H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 该反应△H<0,平衡向生成NO2方向移动 |
D | 在密闭容器中有反应:A+xB(g) | A非气体、x=1 |
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA
B.18gD2O中含有的质子数目为10NA
C.常温常压下,1mol氦气中含有的核外电子数为2NA
D.ag某气体含分子数为b,cg该气体在标况下的体积为22.4ab/(c NA) L。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
实验室某些物质的制备装置如图所示(省略夹持装置和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的是
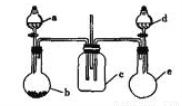
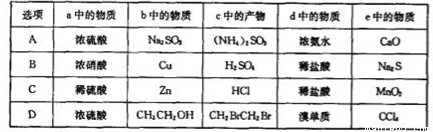
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
橄榄石型LiFePO4是一种锂离子电池正极材料,下列有关LiFePO4 的说法中不正确的是
A.LiFePO4中铁元素的化合价为+2价 B. LiFePO4 中Li、P、O均属于短周期元素
C.LiFePO4能与稀硫酸发生氧化还原反应 D.LiFePO4中Li、Fe、P均属于主族元素
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市宁城县高三上学期摸底统一考试化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如下图所示。
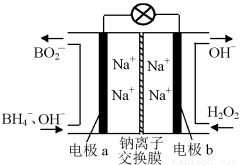
下列说法错误的是( )
A.电池放电时Na+从a极区移向b极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.该电池的负极反应为:BH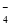 +8OH--8e-=BO
+8OH--8e-=BO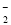 +6H2O
+6H2O
D.每消耗3 mol H2O2,转移的电子为3 mol
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市宁城县高三上学期摸底统一考试化学试卷(解析版) 题型:选择题
下列化合物的一氯代物的数目排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3 ②(CH3)2CHCH(CH3)2
③(CH3)3CCH2CH3 ④(CH3) 3CC(CH3) 3
A.①>②>③>④ B.②>③=①>④
C.③>②>④>① D.③=①>②>④
查看答案和解析>>
科目:高中化学 来源:2014~2015江苏省高一上学期期中化学试卷(解析版) 题型:实验题
(12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
(1)配制0.100 0 mol·L-1和0.010 00 mol·L-1的标准盐酸。
(2)用0.100 0 mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
(3)用测定的Ba(OH)2溶液吸收定量空气的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里,加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
(4)过滤上述所得浊液。
(5)取滤液20.00 mL,用0.010 00 mol·L-1的盐酸滴定,用去盐酸34.80 mL。请回答下列问题:
①配制标准盐酸时,需用下列哪些仪器________;
A.托盘天平
B.容量瓶
C.酸式滴定管
D.量筒
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,左手__________,右手__________,眼睛________________________。
③Ba(OH)2溶液的物质的量浓度是________________________________________;
④过滤所得浊液的目的是_________________________________________________;
⑤此空气样品中含CO2的体积分数为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com