
| A. | 通过装有NaOH溶液的洗气瓶可除去二氧化碳中混有的HCl气体 | |
| B. | 向饱和的NaOH溶液中加入少量的Na2O固体后,恢复到原来的温度时,溶质的物质的量浓度增大 | |
| C. | 某无色溶液中加入BaCl2溶液,有白色沉淀生成,再滴入稀盐酸,沉淀不溶解,说明该溶液中一定含有SO42- | |
| D. | 回收KMnO4加热分解产生的MnO2,可用溶解→过滤→洗涤→干燥 |
分析 A.NaOH和二氧化碳、HCl都反应;
B.饱和的NaOH溶液中加入少量的氧化钠固体后,氧化钠和水反应生成NaOH,导致溶液为过饱和溶液,有NaOH固体析出,恢复到原来的温度时溶液浓度不变;
C.与氯化钡溶液生成不溶于稀盐酸的白色沉淀还可能是氯化银;
D.高锰酸钾是易溶于水的固体,二氧化锰是难溶于水的固体,所以可以采用溶解过滤方法分离.
解答 解:A.NaOH和二氧化碳、HCl都反应,应该用饱和的碳酸氢钠溶液除去二氧化碳中的HCl,故A错误;
B.饱和的NaOH溶液中加入少量的氧化钠固体后,氧化钠和水反应生成NaOH,导致溶液为过饱和溶液,有NaOH固体析出,恢复到原来的温度时溶液浓度不变,则其物质的量浓度不变,故B错误;
C.与氯化钡溶液生成不溶于稀盐酸的白色沉淀还可能是氯化银,所以不能确定一定含有硫酸根离子,故C错误;
D.高锰酸钾是易溶于水的固体,二氧化锰是难溶于水的固体,所以可以采用溶解→过滤→洗涤→干燥方法分离,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及除杂、物质分离和提纯、离子检验等知识点,明确物质性质及实验原理是解本题关键,会根据物质性质差异性采用不同的分离提纯方法,


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 提取溴水中的溴:加入适量乙醇,振荡、静置、分液 | |
| D. | 用结晶、重结晶除去KNO3中的少量NaCl杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 HCl溶液:c(Cl-)>c(H+)>c(OH-) | |
| B. | 1 mol•L-1 Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| C. | 1 mol•L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-) | |
| D. | 0.1 mol•L-1NaOH溶液与等体积pH=1的醋酸混合后的溶液中:c (CH3COO-)=c (Na+)>c (H+)=c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、Cl-、CO32- | B. | Fe2+、Al3+、Cl-、SO42- | ||
| C. | Na+、Cu2+、NO3-、OH- | D. | NH4+、Ba2+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3中含有的3个N-H键是等同的 | B. | NH3中N-H键之间的夹角为107°18′ | ||
| C. | NH3分子空间构型为三角锥形 | D. | NH3的熔点比水的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
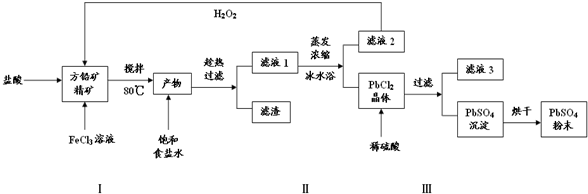
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com