
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据),根据下图回答下列问题:
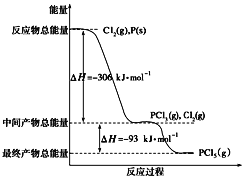
(1)PCl5分解生成PCl3和Cl2的热化学方程式__________________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时还剩余0.6 mol PCl5,其分解率α1等于____________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2____________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是______________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________。
【答案】 PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93 kJ·mol-1 25% 大于 因为PCl5的生成反应是放热反应,温度太高,不利于PCl5的生成 -399 kJ·mol-1
【解析】(1)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g) △H=+93kJmol-1;在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,分解的PCl5为0.2mol,分解率=![]() ×100%=25%;PCl5(g)═PCl3(g)+Cl2(g) △H=+93kJmol-1,为吸热反应,升高温度平衡向正向移动,所以分解率α2大于α1;故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJmol-1;25%;大于;
×100%=25%;PCl5(g)═PCl3(g)+Cl2(g) △H=+93kJmol-1,为吸热反应,升高温度平衡向正向移动,所以分解率α2大于α1;故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJmol-1;25%;大于;
(2)根据(1)的分析可知,Cl2(g)+PCl3(g)=PCl5(g)是放热反应,温度太高,不利于PCl5的生成,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,故答案为:因为PCl5的生成反应是放热反应,温度太高,不利于PCl5的生成;
(3)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:①P(s)+ ![]() Cl2(g)=PCl3(g);△H1=-306 kJ/mol,②Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;根据盖斯定律将①+②得:P(s)+
Cl2(g)=PCl3(g);△H1=-306 kJ/mol,②Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;根据盖斯定律将①+②得:P(s)+ ![]() Cl2(g)=PCl5(g),△H=(-306 kJ/mol)+(-93 kJ/mol)=-399 kJ/mol,故答案为:-399kJmol-1。
Cl2(g)=PCl5(g),△H=(-306 kJ/mol)+(-93 kJ/mol)=-399 kJ/mol,故答案为:-399kJmol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】当硅原子由1s22s22p63s23p2![]() 1s22s22p63s13p3时,以下认识正确的是
1s22s22p63s13p3时,以下认识正确的是
A. 硅原子由基态转化成激发态,这一过程中吸收能量
B. 硅原子由基态转化成激发态,这一过程中释放能量
C. 转化后位于p能级上的两个电子处于同一轨道,且自旋方向相反
D. 转化后硅原子与磷原子电子层结构相同,化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用Na2CO3·10H2O晶体配制240mL 0.1mol/L Na2CO3溶液,回答下列问题:
(1)用托盘天平称取Na2CO3·10H2O的质量为__________g(精确到0.1g)
(2)操作中所需仪器除托盘天平、烧杯、玻璃棒外,还需要_____,_______(填仪器名称)。
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)__________________;
A.用蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平称量所需的Na2CO3·10H2O晶体,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡摇匀
E.改用胶头滴管加水,使溶液凹液面的最低点恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)若出现如下情况,对所配溶液的浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①溶液注入容量瓶前未恢复到室温__________。
②称量时,Na2CO3·10H2O已失去部分结晶水_________;
③若定容时俯视刻度线_______;
④定容摇匀时,发现液面下降,又加水至刻度线_____________;
⑤容量瓶用蒸馏水洗净后没有干燥_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为
A. CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B. CCl4与I2都是直线型分子,而H2O不是直线型分子
C. CCl4和I2都不含氢元素,而H2O中含有氢元素
D. CCl4和I2都是非极性分子,而H2O是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)![]() 2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确是( )
2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确是( )
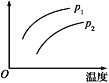
A. 若p1>p2,纵坐标表示A的质量分数
B. 若p1<p2,纵坐标表示C的质量分数
C. 若p1>p2,纵坐标表示混合气体的平均摩尔质量
D. 若p1<p2,纵坐标表示A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误的是

A. c元素的离子半径比e的离子半径小
B. d元素对应的最高价氧化物的水化物酸性比e元素弱
C. b、c、d三种元素对应的最高价氧化物的水化物相互间能发生反应
D. a与b两种元素可形成既有离子键又有非极性共价键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境污染的说法不正确的是( )
A. 燃煤时加入适量石灰石,可减少废气中SO2的量
B. pH在5.6~7之间的降水通常称为酸雨
C. 光化学烟雾的形成主要与NOx和碳氢化合物有关
D. 含磷洗涤剂会导致水体污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的硫酸根离子的物质的量是___________。
(3)相同质量的SO2、SO3的物质的量之比为__________;氧原子的个数之比为_____________。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是_________;ACl2的化学式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com