
| A£®µČĪĀµČĪļÖŹµÄĮæÅضČČÜŅŗÖŠ£¬HF±ČHCNŅ×µēĄė£¬ŌņNaFČÜŅŗµÄpH±ČNaCNČÜŅŗ“ó |
| B£®0.2 mol/L NH4ClČÜŅŗŗĶ0.1 mol/LNaOHČÜŅŗµČĢå»ż»ģŗĻŗó£ŗc(NH4+)£¾c(Cl£)£¾c(Na+)£¾c(OH£)£¾c(H+) |
| C£®ĪļÖŹµÄĮæÅضČĻąµČµÄH2SŗĶNaHS»ģŗĻČÜŅŗÖŠ£ŗc(Na+)= c(S2£)+ c(HS£)+ c(H2S) |
| D£®Ķ¬ÅØ¶ČµÄĻĀĮŠČÜŅŗÖŠ£ŗ¢ŁNH4Al(SO4) 2¢ŚNH4Cl¢ŪCH3COONH4¢ÜNH3”¤H2O£¬c(NH4+)Óɓ󵽊”µÄĖ³ŠņŹĒ¢Ł£¾¢Ś£¾¢Ū£¾¢Ü |


 53ĖęĢĆ²āĻµĮŠ“š°ø
53ĖęĢĆ²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ÖŠŗĶpHŗĶĢå»ż¶¼ĻąĶ¬µÄŃĪĖįŗĶ“×Ėį£¬ĻūŗÄNaOHµÄĪļÖŹµÄĮæÖ®±ČĪŖl£ŗl |
| B£®pH=3µÄŃĪĖįŗĶpH=3µÄFeCl3ČÜŅŗÖŠ£¬Ė®µēĄėµÄc(H+)ĻąµČ |
| C£®0£®1 mol”¤L”ŖNaHC03ČÜŅŗÖŠ£ŗc(Na+)>c(HCO3-)>c(CO32Ņ»)>c(H2C03) |
| D£®ÅØ¶Č¾łĪŖ0£®1 mol£ÆLµÄČżÖÖČÜŅŗ£ŗ¢ŁCH3COOHČÜŅŗ£»¢ŚNaOHČÜŅŗ£»¢ąCH3COONaČÜŅŗ£¬ČÜŅŗµÄPH¢Ś>¢Ū>¢Ł |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®NaHSO3ÓėNa2SO3»ģŗĻČÜŅŗÖŠ£ŗ3c(Na+) = c(HSO3-) + c(SO32-) |
| B£®0.1mol”¤L-1µÄ“×ĖįÄĘČÜŅŗ20 mLÓė0.1mol”¤L-1ŃĪĖį10 mL»ģŗĻŗóČÜŅŗĻŌĖįŠŌ c (CH3COO-)£¾c (Cl-)£¾c (CH3COOH)£¾c (H+) |
| C£®µČĪļÖŹµÄĮæÅØ¶ČµČĢå»żµÄNH4HSO4ŗĶNaOHČÜŅŗ»ģŗĻ£ŗ c(Na+)£½c(SO42-)£¾c(NH4+)£¾c(H+)£¾c(OH-) |
| D£®Ļņ1.00 L 0.3mol”¤L-1NaOHČÜŅŗÖŠ»ŗĀżĶØČė0.2molCO2ĘųĢ壬ČÜŅŗÖŠ£ŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĻąĶ¬Ģõ¼žĻĀ£¬pHĻąĶ¬µÄNaClOŗĶNa2CO3ČÜŅŗ£¬ĪļÖŹµÄĮæÅضČĒ°Õߊ”ÓŚŗóÕß |
| B£®³£ĪĀĻĀ£¬½«CH3COONaČÜŅŗŗĶĻ”ŃĪĖį»ģŗĻÖĮČÜŅŗpH£½7Ź±£ŗ c(Na£«)>c(CH3COO£)>c(Cl£) >c(CH3COOH)>c(H£«)£½c(OH£) |
| C£®Ļņ±„ŗĶNa2CO3ČÜŅŗÖŠĶØČė×ćĮæµÄCO2£¬ČÜŅŗ±ä»ė×Ē£¬ÓÉ“ĖÖ¤Ć÷ĮĖNaHCO3Čܽā¶Č±ČNa2CO3Š” |
| D£®ĀČ¼ī¹¤ŅµŹ¹ÓƵď³ŃĪĖ®ŠčĻČ³żČ„ĘäÖŠµÄCa2+”¢Mg2+”¢SO42-µČŌÓÖŹ”£³żŌÓŹ±£¬“ÖŃĪĖ®ÖŠæÉĻČ¼ÓČė¹żĮæµÄBaCl2ČÜŅŗ£¬ÖĮ³Įµķ²»ŌŁ²śÉśŗó£¬ŌŁ¼ÓČė¹żĮæµÄNa2CO3ŗĶNaOH£¬³ä·Ö·“Ó¦ŗóĀĖČ„³Įµķ£¬ĖłµĆĀĖŅŗÖŠČŌŗ¬ÓŠŅ»¶ØĮæµÄSO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ė®µÄµēĄė³Ģ¶ČŹ¼ÖÕŌö“ó |
| B£®c£ØNH4+£©/c£ØNH3?H2O£©ĻČŌö“óŌŁ¼õŠ” |
| C£®c£ØCH3COOH£©Óėc£ØCH3COO?£©Ö®ŗĶŹ¼ÖÕ±£³Ö²»±ä |
| D£®µ±¼ÓČė°±Ė®µÄĢå»żĪŖ10mLŹ±£¬c(NH4+)=c(CH3COO?) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®³£ĪĀĻĀ£¬PH=9µÄĢ¼ĖįÄĘČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(OH£)=1”Į10-9mol”¤L-1 |
| B£®ĪĀ¶ČĻąĶ¬Ź±£¬ŌŚČõĖįČÜŅŗŗĶĒæ¼īĻ”ČÜŅŗÖŠ£¬Ė®µÄĄė×Ó»ż³£ŹżKwĻąĶ¬ |
| C£®½«pH£½4µÄ“×ĖįČÜŅŗĻ”ŹĶŗó£¬ČÜŅŗÖŠĖłÓŠĄė×ÓµÄÅØ¶Č¾ł½µµĶ |
| D£®ÖŠŗĶµČĢå»żpHĻąĶ¬µÄH2SO4ŗĶHClČÜŅŗ£¬ĻūŗÄNaOHµÄĪļÖŹµÄĮæĪŖ2:1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
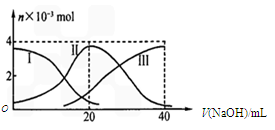
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¼ÓČėŹŹĮæµÄĒāŃõ»ÆÄĘ¹ĢĢå | B£®½«ČÜŅŗĻ”ŹĶµ½ŌĢå»żµÄ 10±¶ |
| C£®¼ÓČėµČĢå»ż0.2 mol”¤L£1°±Ė® | D£®½µµĶČÜŅŗµÄĪĀ¶Č |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com