
【题目】恒温时,向2L密闭容器中通入一定量的气体X和Y,发生反应:3X(g)+Y(g)![]() 2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
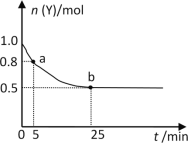
A.该反应为放热反应
B.0~5min内,以X表示的化学反应速率是0.02mol·L-1·min-1
C.b点时该反应达到了最大限度,反应停止
D.25min时,c(Z)=0.5mol·L-1
【答案】D
【解析】
A.由于△H>0,该反应属于吸热反应,故A错误;
B.0~5min内,由图像可知△n(Y)=1mol-0.8mol=0.2mol,则根据3X(g)+Y(g)![]() 2Z(g)可求出△n(X)=0.2mol×3=0.6mol,以X表示的化学反应速率是v(X)=
2Z(g)可求出△n(X)=0.2mol×3=0.6mol,以X表示的化学反应速率是v(X)=  =0.06mol·L-1·min-1,故B错误;
=0.06mol·L-1·min-1,故B错误;
C.b点时该反应达到了最大限度,某一组分的消耗速率与生成速率相等,反应没有停止,故C错误;
D.25min时,由图像可知△n(Y)=1mol-0.5mol=0.5mol,则根据3X(g)+Y(g)![]() 2Z(g)可求出△n(Z)=0.5mol×2=1.0mol,c(Z)=
2Z(g)可求出△n(Z)=0.5mol×2=1.0mol,c(Z)= ![]() =0.5mol/L;故D正确;
=0.5mol/L;故D正确;
答案为D。


科目:高中化学 来源: 题型:
【题目】海带中碘含量比较高,从海带提取碘的操作如下:
(1)将干海带进行灼烧的仪器是________,海带灰中含有较多KI,将海带灰溶于水,然后过滤得到澄清滤液。
(2)向上述滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。请写出离子反应方程式:________________________________。
(3)向上述碘的水溶液中加入适量CCl4,振荡,静置,则I2会转入到CCl4层中,这个过程叫_____________________,现象为____________________________。
(4)3I2+6KOH=5KI+KIO3+3H2O;1.5mol I2完全反应转移电子的物质的量为_____mol;氧化剂与还原剂的物质的量之比为___________。
(5)某一反应体系有反应物和生成物共6种物质:O2、K2Cr2O7、Cr2(SO4)3、H2SO4、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中,氧化剂为____________。氧化产物为____________。
②写出该反应的化学方程式__________________________。
③用单线桥法表示上述反应中电子转移方向和数目________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下[如图为Ba(OH)2和Ca(OH)2的溶解度曲线]:
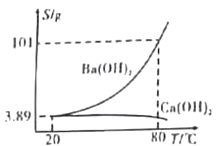
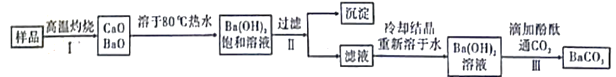
下列有关说法错误的是
A.步骤Ⅰ所需主要仪器是酒精喷灯、铁坩埚、泥三角、玻璃棒等
B.步骤Ⅱ中过滤时的温度对实验无明显影响
C.步骤Ⅲ中,当观察到红色刚好消失时,即可停止通CO2
D.上述过程中涉及到分解、化合、复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需H2取自CH4,CH4和O2作用成CO2、H2(反应①),然而CH4和O2反应还能生成CO2、H2O(反应②),当有水生成时,H2O和CH4反应(反应③)。下表 为三个反应在不同温度下的平衡常数K。

(1)反应①的平衡常数K①的表达式为_______________。
(2)反应①②③的平衡常数K①、K②、K③之间的关系为K②=_____________(用含K①、 K③的式子表示)。反应①②③的反应焓变:ΔH①、ΔH②、ΔH③之间的关系为ΔH①= _____________(用含ΔH②、ΔH③的式子表示)。
(3)恒温条件下,反应③的能量与反应进程关系应对应下图中的_____________,反应② 的能量与反应进程关系应对应下图中的_____________。

(4)为使反应尽可能按生成H2的方向进行,若只考虑反应③,且不降低反应速率,可采 取__________措施;若只考虑反应①②,除采取控温措施外,还可采取_____________(写出两条措施即可)。
(5)250℃时,以镍合金为催化剂,发生CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),向40L 的密闭容器中通入6molCO2(g)和6molCH4(g),平衡时测得体系中CH4的体积分数 为10%,则混合气体的密度为______g/L,CO2的转化率为__________(保留三位有效数字)。
2CO(g)+2H2(g),向40L 的密闭容器中通入6molCO2(g)和6molCH4(g),平衡时测得体系中CH4的体积分数 为10%,则混合气体的密度为______g/L,CO2的转化率为__________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoP、FeS2、NiS2等物质对电化学氢析出反应有良好的催化活性和稳定性。请回答下列问题:
(1)基态Co原子价层电子的电子排布图(轨道表达式)为________________,基态P原子的电子占据最高能级的电子云轮廓图为_______。
(2)PH3的沸点_____(填“高于”或“低于”)NH3,原因是______________。
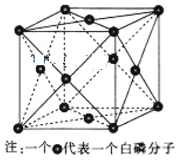
(3)下图为白磷(P4)的晶胞示意图,晶胞的边长为a nm,设阿伏加德罗常数的数值为NA,其晶体密度的计算表达式为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图所示。横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42—)”。下列说法正确的是
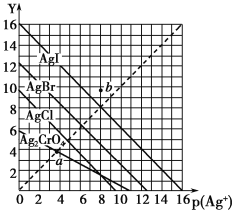
A. a点表示c(Ag+)=c(CrO42—)
B. b点可表示AgI的饱和溶液
C. 该温度下AgI的Ksp约为1×10-16
D. 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)今有如下两个热化学方程式:则a _____ b (填“>”、“=”或“<”)
H2(g)+![]() O2(g)═H2O (l) △H1=a kJmol﹣1
O2(g)═H2O (l) △H1=a kJmol﹣1
H2(g)+![]() O2(g)═H2O (g) △H2=b kJmol﹣1
O2(g)═H2O (g) △H2=b kJmol﹣1
(2)拆开lmol气态物质中某种共价键需要吸收的能量叫键能,部分化学键键能如表。
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | a | 945 |
已知反应N2(g)+3H2(g)=2NH3(g) △H=-93 kJmol﹣1,试根据表中所列键能数据计算a=______________。
(3)利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+ CO(g)═ CH3OH(g) △H1
②2CH3OH(g)═ CH3OCH3(g)+ H2O(g) △H2
③3 H2(g)+3CO(g)═ CO2(g) + CH3OCH3(g) △H3
反应③为制取二甲醚的第3步反应,利用△H1和△H2计算△H3时,还需要利用________反应的△H。
(4)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如图。
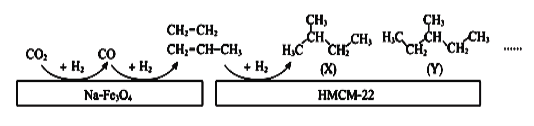
图中CO2转化为CO的反应为: CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
已知:2CO2(g) + 6H2(g) = C2H4(g) + 4H2O(g) △H= -128kJ/mol
则图中CO转化为C2H4的热化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如图:
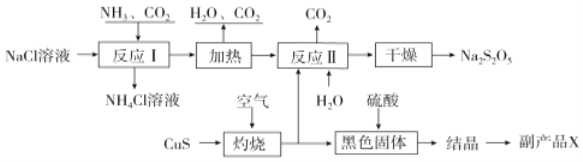
已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:______。
(2)反应I的化学方程式为______。
(3)“灼烧”时发生反应的化学方程式:______。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为______。
(5)副产品X的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com