
 (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.| 物质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒精(水) |
分析 (1)乙烯能使高锰酸钾褪色,能和溴水发生加成反应,而甲烷则不能;水遇无水硫酸铜变蓝,能被生石灰吸收而乙醇则不能;
(2)根据饱和碳酸钠溶液能降低了乙酸乙酯的溶解度,同时还能除去混有的乙醇和乙酸分析,浓硫酸做酯化反应的催化剂和吸水剂.
解答 解:(1)乙烯能使高锰酸钾褪色,甲烷不能,所以可以用高锰酸钾检验乙烯和甲烷,乙烯可以和加成试剂发生加成反应,而甲烷不能,可以用溴水来除去甲烷中的乙烯;水遇到无水硫酸铜变蓝,而乙醇不能,所以可以用无水乙醇来检验酒精中的水,水可以和生石灰反应,而乙醇不反应,工业上就是向酒精中加入生石灰来制无水酒精的,
故答案为:
| 物 质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | B | d |
| 酒 精(水) | A | c |
点评 本题考查物质的分离、提纯问题,题目难度不大,本题注意根据物质的性质选择分离方法,注意不能引入新的杂质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
关于酸、碱、盐的下列各种说法中,正确的是
A.化合物电离时,生成的阳离子有氢离子的是酸
B.化合物电离时,生成的阴离子有氢氧根离子的是碱
C.化合物电离时,生成金属阳离子和酸根离子的是盐
D.NH4Cl通电时能电离出NH4+和Cl?,所以NH4Cl是盐
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
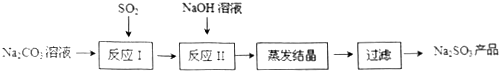
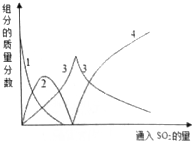
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
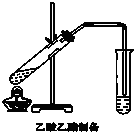
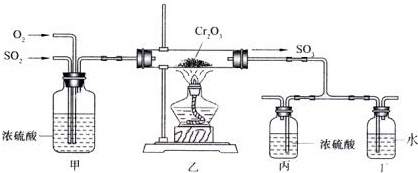
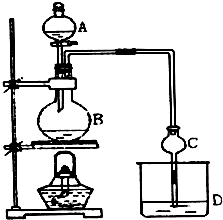 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$N2H4+$\frac{1}{2}$O2═$\frac{1}{2}$N2+H2O△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.氧化还原反应一定有氧元素参加 B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生 D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
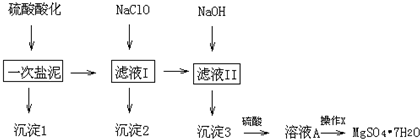
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| Al(OH)3 | 3.7 | 5.7 |
| 开始溶解:7.8 | 完全溶解:10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
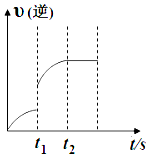 已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )
已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )| A. | t1时改变的条件可能是使用催化剂 | |
| B. | t1时改变的条件可能是增大 H2O 浓度 | |
| C. | t1~t2这段时间内的化学反应速率 v(H2O)=$\frac{{t}_{2}-{t}_{1}}{0.15}$ | |
| D. | t2后继续加入 2 mol C(s)平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com