
【题目】实验题
Ⅰ.课本实验
(1)苯甲酸的重结晶实验操作步骤是_________、__________、__________、分离晶体,粗苯甲酸溶解后还要加点水的目的是________________。
(2)为了验证溴乙烷中含有溴元素,有以下操作:①加硝酸银溶液 ②加NaOH溶液 ③加热 ④加蒸馏水 ⑤加硝酸至溶液显酸性,合理的顺序是(______)
A、②①③⑤ B、②④⑤③ C、②③⑤① D、②①⑤③
(3)在溴乙烷与NaOH乙醇溶液的消去反应中可以观察到有气体生成。有人设计了实验方案来检验生成的气体是否为乙烯,如图所示。

①Ⅰ中水的作用____________。
②Ⅱ中还可用________________,若用此物质,此时______(填“有”或“无”)必要将气体先通入水中。
Ⅱ.拓展实验
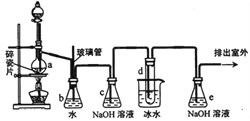
1,2一二溴乙烷可作抗爆剂的添加剂。下图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴。
已知:
相关数据列表如下:
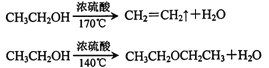
(1)实验中应迅速将温度升高到170℃左右的原因是__________________。
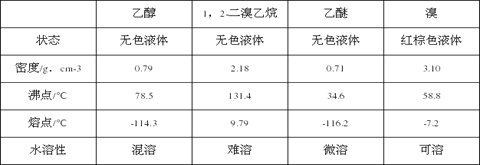
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象__________________;如果实验中导管d堵塞,你认为可能的原因是__________________;安全瓶b还可以起到的作用是___________________________;
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________;
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因___________________________;
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为_______,要进一步提纯,下列操作中必须的是__________________(填入正确选项前的字母)。
A. 重结晶 B.过滤 C.萃取 D.蒸馏
【答案】 加热溶解 趁热过滤 冷却结晶 减少苯甲酸的损失 C 除去乙醇 溴水 无 减少副产物乙醚生成 b中长直玻璃管内有一段液柱上升 过度冷却,产品1 , 2-二溴乙烷在装置d中凝固 防止倒吸 吸收乙烯气体中含有的CO2、SO2等酸性气体 发生副反应生成乙醚或乙醇挥发 或乙烯流速过快,未完全发生加成反应 乙醚 D
【解析】本题考查实验方案设计与评价,I.(1)苯甲酸的重结晶实验操作步骤是先加热溶解,然后趁热过滤,冷却结晶,然后根据过滤,洗涤;粗苯甲酸溶解后还要加点水的目的是减少本就哎算的损失;(2)验证溴乙烷种溴元素,首先让溴元素转化成Br-,即将溴乙烷加入到NaOH溶液中并加热,加热一段时间后,冷却,加硝酸至溶液显酸性,再加入AgNO3溶液,出现淡黄色沉淀,说明溴乙烷种含有溴元素,正确的顺序是②③⑤①,故选项C正确;(3)①溴乙烷与氢氧化钠的乙醇溶液反应需要加热,加快反应速率,但乙醇以挥发,气体中混有乙醇,乙醇也能使酸性高锰酸钾溶液褪色,因此必须除去乙醇,即I中水的作用是除去乙醇;②乙烯能使溴水褪色,因此II中可以用溴水代替,乙醇不与溴水反应,乙醇不能使溴水褪色,因此不要将其踢先通入水中,应填“无”;II.(1)根据已知,在加热到140℃时会产生乙醚,因此要让温度迅速升高到170℃左右,目的是减少副产物乙醚的生成;(2)导管d发生堵塞,造成a、b、c中气体压强增大,即b中长直玻璃管内有一段液柱上升;冰水的温度为0℃,根据表格中数据,1,2-二溴乙烷的熔点为9.79℃,使1,2-二溴乙烷由液体转化成固体,堵塞导管d;安全瓶b还起到防倒吸的作用;(3)浓硫酸具有脱水性,能使乙醇碳化,C和浓硫酸在加热条件下发生反应生成CO2和SO2,c中NaOH溶液作用是吸收乙烯气体中含有的CO2、SO2等酸性气体;(4)发生副反应生成乙醚或乙醇挥发或乙烯流速过快,未完全发生加成反应;(5)升高到170℃时,必定经过140℃,会产生乙醚,因此杂质为乙醚,利用乙醚和1,2-二溴乙烷的沸点不同,采用蒸馏的方法,故选项D正确。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 以铁作阳极,铂作阴极,电解饱和食盐水,可以制备烧碱
B. 25℃下,在NH3·H2O稀溶液中加水稀释,![]() 的值不变
的值不变
C. 工业生产硫酸时,接触室催化氧化S02时使用热交换器可以充分利用热量,降低生产成本
D. 反应![]() 室温下不能自发进行,则△H>0
室温下不能自发进行,则△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
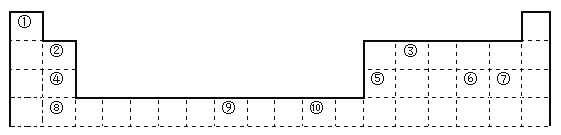
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是___________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为_________。
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有______个,π键有______个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_______;该元素与元素①形成的分子X的空间构形为___________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物分离和提纯的装置。
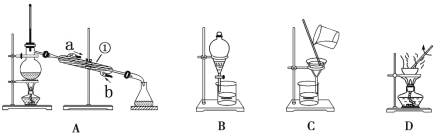
回答下列问题:
(1)从KCl溶液中得到KCl固体,选择装置_________(填代表装置图的字母,下同);除去自来水中的Cl 等杂质,选择装置____________。从碘水中分离出I2,选择装置___________,该分离方法的名称为_________。
(2)装置A可用于酒精和水的混合物的分离。①的名称是_____________,该装置是利用酒精和水的______不同,将它们分离。通冷却水的方向是从______进_____出(填字母)。锥形瓶中收集到的液体主要是_____________。(已知:酒精的沸点是78.3℃,熔点是-114.1℃;水的沸点是100℃,熔点是0℃;)
(3)从碘水中得到碘时,若加入的萃取剂是四氯化碳,则下层显____________。
(4)当装置B在分液时,打开活塞后发现液体不能顺利滴下,其可能的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.玫瑰的香味物质中包含苧烯,苧烯的键线式为![]()
(1)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构:________________________(用键线式表示)。
(2)有机物A是苧烯的同分异构体,分子中含有![]() 结构,A可能的结构有____种。
结构,A可能的结构有____种。
II.某烃键线式为![]() ,该烃与Br2以物质的量之比1: l加成时,所得产物有_______种。
,该烃与Br2以物质的量之比1: l加成时,所得产物有_______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是
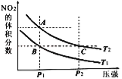
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室蒸馏石油的实验装置,实验需要收集60~150℃和150~300℃的馏分。请回答下列问题:
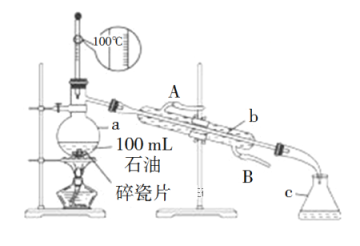
(1)仪器a的规格和名称:_______,仪器b、c的名称:b_______,c_______。
(2)温度计的使用是否正确_______(“正确”或“错误”)。
(3)实验时在仪器a中加入了少量碎瓷片,其目的是_______。
(4)实验时在仪器b中通入冷却水,请指明冷却水的流向_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
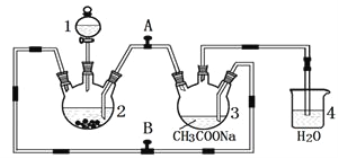
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为______________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
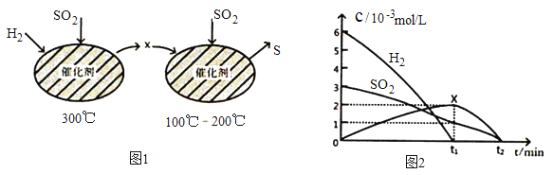
①分析可知X为____________(写化学式),0~t1时间段的温度为_________,0~t1时间段用SO2表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,比较Na2SO3溶液中各离子浓度的大小关系为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com