
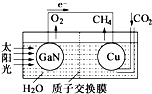
 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应,有O2产生 | |
| C. | 电解液中的H+从质子交换膜右侧向左侧迁移 | |
| D. | Cu表面的电极反应式 CO2+8e-+8H+═CH4+2H2O |
分析 该装置中,根据电子流向知,GaN是负极、Cu是正极,负极反应式为:2H2O-4e-=4H++O2↑,正极反应式为:CO2+8e-+8H+=CH4+2H2O,电解质溶液中阳离子向正极移动,据此分析解答.
解答 解:A.根据图示可知,该装置中将太阳能转化为化学能的过程,故A正确;
B.根据图示可知,GaN表面有氧气生成,发生反应为2H2O-4e-=4H++O2↑,所以GaN表面发生氧化反应,故B正确;
C.放电时,电解质溶液中阳离子向正极移动,所以装置中的H+由左向右移动,故C错误;
D.根据电子流向知,Cu是正极,正极上二氧化碳得电子和氢离子反应生成甲烷,电极反应式为:CO2+8e-+8H+=CH4+2H2O,故D正确;
故选C.
点评 本题考查化学电源新型电池,题目难度中等,明确原电池原理为解答根据,注意正确判断电极反应、电子流向、离子流向,难点是电极反应式的书写.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定含有CO32- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42- | D. | 可能含有SO42-也可能含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | a+b>c+d | ||
| C. | C的体积分数降低 | D. | B的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
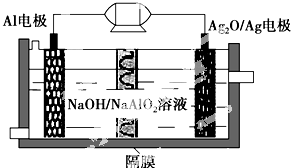 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )| A. | 工作时正极发生还原反应 | |
| B. | 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol | |
| C. | Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O | |
| D. | 工作时电解液中的Na+透过隔膜移向Al电极放电充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 加入试剂 | 离子方程式 |
| NH4Cl(AlCl3)溶液 | ||
| NaHCO3(Na2CO3)溶液 | ||
| Fe 粉(Al粉) | ||
| FeCl3(FeCl2)溶液 |
 15.(18分)
15.(18分) ,反应类型是加聚反应.
,反应类型是加聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
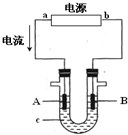 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com