
【题目】ZnSO4 受热分解过程中各物质物质的量随温度变化关系如图所示(A、B为含硫的氧化物),下列说法正确的是( )
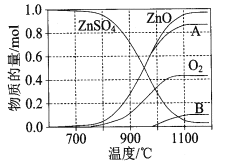
A.ZnO 属于金属晶体
B.SO3 和 SO2 互为同素异形体
C.物质 A、B 分别是 SO3、SO2
D.700℃~980℃时发生反应的化学方程式为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑
2ZnO+2SO2↑+O2↑
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() 标准状况
标准状况![]() 和
和![]() 的混合气体中含电子总数为
的混合气体中含电子总数为![]()
B.![]() 氢化钾
氢化钾![]() 与足量水反应转移电子数为
与足量水反应转移电子数为![]()
C.92g甘油![]() 丙三醇
丙三醇![]() 中含C一H键总数为
中含C一H键总数为![]()
D.![]() 溶液中
溶液中![]() 和
和![]() 数之和为
数之和为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期主族元素并且原子序数依次增大,其中只有A、B、C在同一周期。A元素原子核外成对电子数是未成对电子数的2倍;B元素最外层有3个未成对电子;C元素核外有3对成对电子;D元素是所在周期中原子半径最小的;E元素位于周期表的第四周期第九列。请根据相关信息,应化学用语回答下列问题:
(1)A的基态原子核中核外有___种运动状态不同的电子;B的基态原子中电子占据最高能级的电子云轮廓图为____。D的基态原子核外有____种能量不同的电子。
(2)B的氢化物BH3的VSEPR模型为____,其分子空间构型为_____;A、B、C三种元素的第一电离能由大到小的顺序为_____(填元素符号)。
(3)BO2-中B原子的杂化轨道类型为____;与AB-互为等电子体的分子有_____,离子有_____。(分别写出1种)
(4)由A、C与氢形成H2A2C4分子中,1mol该分子中含有π键的数目为____。
(5)E元素位于元素周期表中的___区,E3+的一种配离子[E(BH3)5D]2+中,E3+的配位数为____,配位原子为____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
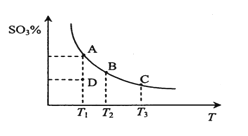
A. 反应2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D点时v(正)<v(逆)
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g) +Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=_____________
(2)能判断该反应已经达到平衡状态的是_____________
A.生成X的速率是生成Z的速率的2倍
B.容器内压强保持不变
C.容器内气体的密度保持不变
D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是_____________(任写一种)。
(4)温度为300℃时,该反应的化学平衡常数K=_______________
(5)若起始时向该容器中充入X、Y、Z各0.20 mol,则反应将向____(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比______(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅丹(Pb3O4)可作防锈用涂料,已知铅丹中Pb元素的化合价只有+2、+4,且+2价稳定,+4价的Pb具有强氧化性,能氧化浓盐酸生成Cl2。则下列说法不正确的是 ( )
A. Pb3O4可表示为2PbO·PbO2
B. 可用PbO在空气中加热制备铅丹,其n(氧化剂):n(还原剂)=1:6
C. 0.1mol Pb3O4与足量的浓盐酸反应,生成Cl20.1 mol
D. a mol Pb3O4加强热分解生成PbO,则加热过程中转移电子数为2a NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为CO2分子晶体结构的一部分,观察图形。试说明每个 CO2分子周围有________个与之紧邻且等距的 CO2分子;该结构单元平均占有________个CO2分子。
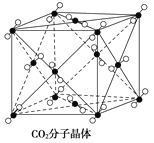
(2)在40 GPa高压下,用激光器加热到1800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是________。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4 mol C—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下列转化关系,请回答下列问题(部分反应条件未注明)。
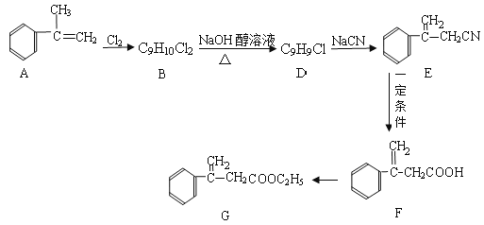
(1)F的官能团名称________________;
(2)B→D的化学反应方程式为____________;
(3)D→E的化学反应类型为_____________________;
(4)F转化为G的化学反应方程式为_________________;
(5)H是F的同分异构体,它是苯的邻位二取代物,遇FeCl3溶液显示特征颜色,则H可能的结构简式为(任写一种)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com