
【题目】氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用下图所示装置制备干燥纯净的氯气,请回答下列问题。
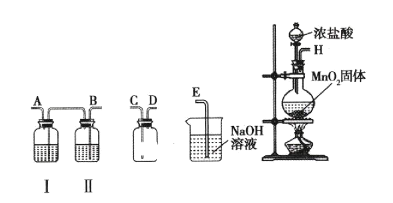
(1)I中所盛试剂为________(填序号,下同),II中所盛试剂为________。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→____、____、→____、____→____;选择最后一个装置的目的是___________________。
(3)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:____。
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定含有![]() ,请设计实验探究该样品中可能存在的其他物质。
,请设计实验探究该样品中可能存在的其他物质。
I.提出合理假设。
假设1:该漂白粉未变质,含有_______________________;
假设2:该漂白粉全部变质,含有_________________________;
假设3:该漂白粉部分变质,既含有![]() ,又含有
,又含有![]() 。
。
【答案】C B B A C D E 吸收尾气,防止污染空气 ![]()
![]()
![]()
【解析】
(1)H导出的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,采取向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余的氯气,防止污染空气,用氢氧化钠溶液吸收氯气防止倒吸,各装置中气体应为长进短出;I中所盛试剂为浓硫酸,答案选C;II中所盛试剂为饱和食盐水,答案选B;
(2)实验室制取氯气时,首先要制取氯气,然后通过饱和食盐水除去挥发出来的氯化氢气体,通过浓硫酸除去混入的水蒸气,这时得到了干燥、纯净的氯气,要用向上排空气法收集氯气,最后要吸收多余的氯气,注意防止倒吸,仪器连接为H→B→A→C→D→E;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)①漂白粉的主要成分为CaCl2和Ca(ClO)2,变质生成CaCO3,则漂白粉未变质,只含CaCl2、Ca(ClO)2,漂白粉全部变质,只含CaCl2、CaCO3,漂白粉部分变质,既含有CaCl2、Ca(ClO)2、CaCO3。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
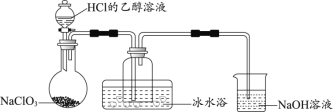
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O。
①冰水浴的作用是____________。
② NaOH溶液中发生的主要反应的离子方程式为________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到____,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是_____________________(填字母序号)。
a. FeSO4 b. O3 c. KMnO4 d. SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为______________________。
②净水过程中,K2FeO4起到吸附、絮凝作用的原理是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)常温下,向100mL0.01molL-1HA的溶液中逐滴加入0.02molL-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

①常温下,0.01molL-1HA溶液中由水电离出的c(H+)=______molL-1。
②常温下一定浓度的MA稀溶液的pH=a,则a__7(填“>”、“<”或“=”),用离子方程式表示其原因为_______________________________________;
③X点时,溶液中c(H+)、c(M+)、c(A—)由大到小的顺序是___________________;
④K点时,溶液中c(H+)+c(M+)—c(OH—)=____molL-1。
⑵20℃时,在c(H2C2O4)+c(HC2O4—)+c(C2O42—)=0.100molL—1的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。

①Q点:c(H2C2O4)______c(HC2O4—)(填“>”、“<”或“=”)
②该温度下HC2O4-的电离常数K=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法不正确的是

A. 两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B. 开始时发生的是析氢腐蚀
C. 一段时间后发生的是吸氧腐蚀
D. 析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的数值。下列说法正确的是
A.1 mol OH—含有的电子数为NA
B.将7.1 g Cl2通入水中,转移电子数为0.1NA
C.标准状况下,11.2 L O2、CO2混合气体含有的氧原子数为NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,含有的NH![]() 数为0.1NA
数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
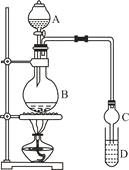
【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能作为所得结论合理证据的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | NaBr溶液变为橙色,NaI溶液变为棕黄色 | Mg条表面有气泡产生 | Na2SiO3溶液中出现白色沉淀 | 钾与水反应比钠与水反应更剧烈 |
结论 | 氧化性: Cl2>Br2>I2 | 还原性: Mg>Al | 非金属性: C>Si | 金属性: K>Na |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(2)酸浸后,钛主要以TOCl42-形式存在,写出相应反应的离子方程式_________________。
(3)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________________________
丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________;
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,反应的离子方程式为___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com