
(13分)实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。
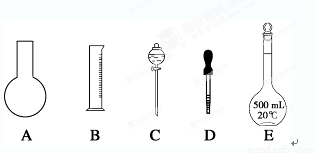
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol/L(填“大于”、“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_______0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________。
(1) A、C 烧杯、玻璃棒 (2)B、C、F 【(1) (2)中每个答案1分】 (3) 2.0 小于 小于 (每空1分)
(4) 13.6 15 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌(每空2分)
【解析】(1)圆底烧瓶和分液漏斗在一定物质的量浓度溶液配制中不需要,答案选AC;溶质稀释和转移时还需要烧杯和玻璃棒。
(2)容量瓶不能长时间储存溶液,B正确;由于容量瓶只有一条刻度线,所以不能测量容量瓶规格以下的任意体积的液体,C正确;容量瓶不能用来加热固体,所以选项F正确,即答案选BCF。
(3)由于没有450ml容量瓶,所以只能配制500ml容量瓶,所以需要氢氧化钠的质量是0.5L×0.1mol/L×40g/mol=2.0g;若定容时仰视刻度线,则容量瓶中溶液的体积偏大,浓度偏小;若NaOH溶液在转移至容量瓶时,洒落了少许,则溶质减少,所以浓度偏小。
(4)硫酸的物质的量是0.5L×0.5mol/L=0.25mol,则需要浓硫酸的体积是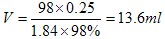 ;量筒的规格越接近13.6ml,误差越小,所以选择15ml的量筒;由于浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的,所以正确的稀释应该是将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌。
;量筒的规格越接近13.6ml,误差越小,所以选择15ml的量筒;由于浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的,所以正确的稀释应该是将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
若X、Y两种元素在周期表中位于同一主族,其中一种为短周期元素,且两者相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):
Xm+ Yn + H2O → HXO3 + HY。请回答:
⑴该反应的还原剂的电子式为___________________。
⑵配平上述化学方程式(用化学式表示):
⑶若某化学反应如下:(未配平)KX + Yn + H2O → KXO3 + Xm + HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目:
KX + Yn + H2O →
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中由NaYO歧化生成NaYO3的离子方程式为(用化学式表示):______________________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。在2L 3 mol·L-1的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1 mol·L-1。[已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变]
查看答案和解析>>
科目:高中化学 来源:2011届浙江省嘉兴一中高三高考模拟试题(理综)化学部分 题型:填空题
若X、Y两种元素在周期表中位于同一主族,其中一种为短周期元素,且两者相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):
Xm + Yn + H2O → HXO3 + HY。请回答:
⑴该反应的还原剂的电子式为___________________。
⑵配平上述化学方程式(用化学式表示):
⑶若某化学反应如下:(未配平)KX + Yn + H2O → KXO3 + Xm + HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目:
KX + Yn + H2O →
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中由NaYO歧化生成NaYO3的离子方程式为(用化学式表示):______________________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。在2L 3 mol·L-1的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1 mol·L-1。[已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变]
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省九校高三第二次联考理综化学试卷(解析版) 题型:实验题
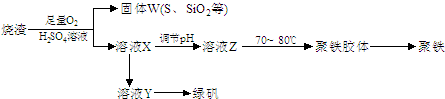
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m, 广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是:________________________。
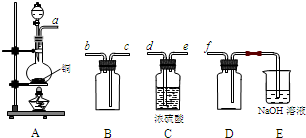
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。

装置A中发生反应的化学方程式为_________________________________________。
(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_____________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年天津市南开区高三一模考试(理综)化学部分 题型:实验题
(18分)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m, 广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是:
___________________________________________________________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。
装置A中发生反应的化学方程式为_________________________________________。
装置D的作用是_____________,装置E中NaOH溶液的作用是__________________。

(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_______________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,定容时视线应_____________________,直到_____________________。用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com