
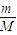 计算碳酸钙的物质的量,令FeO和Fe3O4混的物质的量分别为xmol、ymol,列方程计算x、y的值,据此判断.
计算碳酸钙的物质的量,令FeO和Fe3O4混的物质的量分别为xmol、ymol,列方程计算x、y的值,据此判断.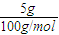 =0.05mol,根据碳原子守恒可知n(CO2)=0.05mol,
=0.05mol,根据碳原子守恒可知n(CO2)=0.05mol,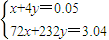


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:模拟题 题型:实验题
 FeO+CO2↑+CO↑+2H2O。甲同学欲检验晶体分解生成的CO2、CO和水蒸气,设计了如下实验装置(央持仪器已略去):
FeO+CO2↑+CO↑+2H2O。甲同学欲检验晶体分解生成的CO2、CO和水蒸气,设计了如下实验装置(央持仪器已略去): 
 Fe+CO2,请你设汁一个简单的化学实验验证该结论(写出实验操作步骤、现象与结论):__________________________。
Fe+CO2,请你设汁一个简单的化学实验验证该结论(写出实验操作步骤、现象与结论):__________________________。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com