

分析 (1)①已知:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.5kJ•mol-1①
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1②,
根据盖斯定律①-②×2可得:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g),据此计算;
②尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O,CO(NH2)2与NO2反应生成氮气、二氧化碳和水;
(2)①根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算;
②V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO4,VOSO4 分解生成V2O5、SO2、SO3;
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵,依据氨气和三氧化硫的物质的量之比判断生成产物;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应;
②O3氧化NO2产生N2O5.
解答 解:(1)①已知:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.5kJ•mol-1①
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1②,
根据盖斯定律①-②×2可得:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H=(-905.5kJ•mol-1)-(+180kJ•mol-1)×2=-1625.5kJ/mol;
故答案为:-1625.5kJ/mol;
②据原子守恒和电子守恒,可以写为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O,
故答案为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O;
(2)①氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,amolNH3反应失去电子3amol,1mol O2得到4mol电子,bmolO2反应得到电子4bmol,则NO转化为N2得到的电子为$\frac{3a-4b}{2}$mol,
故答案为:$\frac{3a-4b}{2}$mol;
②V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO4,VOSO4 分解生成V2O5、SO2、SO3,
该催化循环机理的化学方程式为:SO2+V2O5═SO3+V2O4,
2SO2+O2+V2O4=2VOSO4,
2VOSO4=V2O5+SO2+SO3,
故答案为:2SO2+O2+V2O4=2VOSO4;
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.分析n(NH3):n(SO3)对硫酸氢铵及硫酸铵形成的影响可知,三氧化硫越多生成产物为硫酸氢氨,氨气越多生成的产物为硫酸铵,则图5中A、C区域代表的物质分别为(NH4)2SO4,NH4HSO4;,
故答案为:(NH4)2SO4,NH4HSO4;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H2O+HNO2-2e-=3H++NO3-,
故答案为:H2O+HNO2-2e-=3H++NO3-;
②O3也可用于烟气脱硝.二氧化氮中氮元素化合价+4价,O3氧化NO2的氧化产物为+5价氮的化合物为N2O5,
故答案为:N2O5 .
点评 本题考查了盖斯定律的应用、化学方程式的书写、电解原理的应用、氧化还原反应、图象的分析与应用等,考查了学生的分析能力以及对基础知识的综合应用能力,题目难度中等.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | O=O | H-O |
| 键能(KJ/mol) | 436 | 496 | 463 |
| A. | 242KJ | B. | 442 KJ | C. | 484 KJ | D. | 448KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.
碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
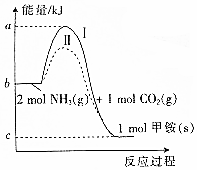 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
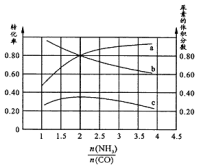 用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.
用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com