
 工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.| 序号 | 实验装置 | 阳极实验现象 | 阴极 |
| 实验Ⅰ | 电压1.5V电解1 mol/L FeCl2溶液,pH=4.9 | 阳极表面没有气泡生成;阳极附近溶液逐渐变浑浊,颜色变成黄绿色;最终石墨电极表面附有少量红褐色固体. | 没有观察到气泡生成,铜电极表面有银灰色金属光泽的固体析出. |
| 实验序号 | pH | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅱ | 2.4 | 无 | 未变色 | 黄绿色,少量浑浊 | 无 | 有 |
| 实验Ⅲ | -0.4 | 无 | 未变色 | 黄绿色,无浑浊 | 有 | 无 |
| 实验序号 | 电压 (V) | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅳ | 3 | 无 | 未变色 | 缓慢变成黄绿色,有浑浊 | 少量 | 有,约1min |
| 实验Ⅴ | 6 | 少量 | 变蓝 | 很快变成黄绿色,有浑浊 | 大量 | 有,迅速 |
分析 (1)氯化亚铁溶液中水解,亚铁离子易被氧化,配制溶液时抑制水解,防止氧化;
(2)电解过程中溶液中阴离子氯离子、氢氧根离子移向阳极放电;
(3)阳极表面没有气泡生成;阳极附近溶液逐渐变浑浊,颜色变成黄绿色;最终石墨电极表面附有少量红褐色固体.说明阳极生成氢氧化铁,取阳极附近浑浊液于试管中,滴加KSCN溶液,没有明显变化,证明铁离子沉淀,但是滴加少量盐酸后,沉淀溶解溶液中铁离子结合SCN-生成血红色溶液;
(4)图表中数据分析可知随PH减小,无气体生成,无使淀粉碘化钾试纸变蓝的氯气生成,电极附近得到氢氧化亚铁,酸性越强,无浑浊现象,阴极上氢离子浓度越大,会有气泡生成,无金属镀层,氢离子浓度越小,无气体生成,会生成金属镀层;
(5)①氯气具有氧化性,亚讨论组具有还原性,阳极产生的Cl2将Fe2+氧化为Fe3+;
②阴极都有镀层出现,是亚铁离子得到电子生成铁;
(6)根据Ⅰ~Ⅴ实验探究,电解时影响离子放电顺序的因素有浓度、电压、酸碱性等;
解答 解:(1)用FeCl2固体配制FeCl2溶液时需再向溶液中加入少量铁粉和盐酸,Fe2++2H2O?Fe(OH)2+2H+加入HCl溶液,抑制水解;2Fe3++Fe═3Fe2+防止Fe2+被氧化,
故答案为:加酸抑制Fe2+水解,加Fe粉防止Fe2+氧化;
(2)电解过程中溶液中阴离子氯离子、氢氧根离子移向阳极,失电子能力Cl->OH-,阳极气泡为生成的氯气,
故答案为:Cl2;
(3)阳极表面没有气泡生成;阳极附近溶液逐渐变浑浊,颜色变成黄绿色;最终石墨电极表面附有少量红褐色固体.说明阳极生成氢氧化铁,已知:Fe(OH)3开始沉淀时pH=1.5,完全沉淀时pH=2.8甲同学取阳极附近浑浊液于试管中,滴加KSCN溶液,没有明显变化,但是滴加少量盐酸后,溶液变成红色,氢氧化铁溶解得到铁离子溶液,结合SCN-生成血红色溶液,说明阳极附近无氯气生成,
故答案为:红; Cl2;
(4)图表中数据分析可知随PH减小,无气体生成,无使淀粉碘化钾试纸变蓝的氯气生成,电极附近得到氢氧化亚铁,酸性越强,无浑浊现象,阴极上氢离子浓度越大,会有气泡生成,无金属镀层,氢离子浓度越小,无气体生成,会生成金属镀层,由实验Ⅱ、Ⅲ得出的结论是阴极在酸性较强时,H+优先于Fe2+放电,
故答案为:阴极在酸性较强时,H+优先于Fe2+放电;
(5)①氯气具有氧化性,亚讨论组具有还原性,阳极产生的Cl2将Fe2+氧化为Fe3+,肺炎的离子方程式为:
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;
②实验Ⅳ和Ⅴ中,阴极都有镀层出现,是亚铁离子得到电子生成铁,阴极的电极反应式是:Fe2++2e-═Fe,
故答案为:Fe2++2e-═Fe;
(6)根据Ⅰ~Ⅴ实验探究,电解时影响离子放电顺序的因素有浓度、电压、酸碱性等,
故答案为:电压、溶液的酸碱性;
点评 本题考查了物质性质实验探究、电解原理、电解产物和条件的影响关系、实验现象的判断和归纳,掌握基础是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z<W | |
| B. | Z分别与X、Y形成的化合物中,化学键类型均相同 | |
| C. | X分别与Y、W形成的最简单化合物的稳定性:W<Y | |
| D. | 由以上四种元素形成的化合物一定能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
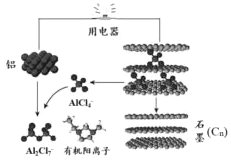 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时的阳极反应为:Cn+AlCl4--e-=CnAlCl4 | |
| B. | 放电时,铝为负极、石墨为正极 | |
| C. | 放电时,有机阳离子向铝电极方向移动 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-=4Al2Cl7- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
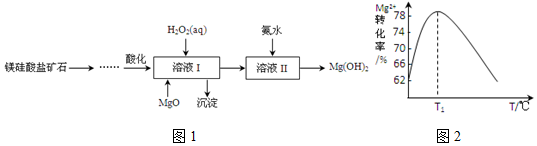
 .溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
.溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用SO2漂白过的草帽日久会变色 | |
| B. | 用天燃气代替煤作燃料可减少大气污 | |
| C. | “84消毒液”杀死病菌是因为蛋白质变性 | |
| D. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A. | 含0.5 mol HCl的稀溶液与含 0.55 mol NaOH的稀溶液混合 | 测得放出热量为a kJ | 强酸与强碱反应的中和热为2a kJ/mol |
| B. | 向CuCl2、MgCl2的混合溶液中滴加NaOH溶液 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C. | 将铁钉和铜丝用导线连接后放入滴有酚酞的氯化铵溶液中 | 铜丝附近溶液变红色 | 铁发生吸氧腐蚀 |
| D. | 向某未知溶液中滴加酸性KMnO4溶液 | KMnO4溶液褪色 | 溶液中有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com