
| A. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ | |
| C. | 0.2mol/L的NaHCO3溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+) | |
| D. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
分析 A.pH为4的NaHB溶液,说明HB-电离程度大于水解程度;
B.酸溶液抑制了水的电离,能够水解的盐溶液促进了水的电离,据此进行判断;
C.把0.2mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,二者发生反应NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,溶液中的溶质是NaOH和Ba(OH)2,二者的物质的量浓度分别为0.1mol/L、0.05mol/L,再结合物料守恒判断;
D.根据两溶液中的物料守恒判断.
解答 解:A.pH为4的NaHB溶液,说明HB-电离程度大于水解程度,则c(B2-)>c(H2B),故A错误;
B.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中,氯化铵溶液中铵根离子水解促进了水的电离,而醋酸和盐酸都是酸溶液,二者都抑制了水的电离,由于溶液pH相等,则溶液中氢离子浓度相等,说明对水的电离的抑制程度相同,所以三种溶液中由水电离出的c(H+)大小为:①>②=③,故B错误;
C.把0.2mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,二者发生反应NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,溶液中的溶质是NaOH和Ba(OH)2,二者的物质的量浓度分别为0.1mol/L、0.05mol/L,根据物料守恒可知混合溶液中离子浓度大小顺序为:c(OH-)>c(Na+)>c(Ba2+)>c(H+),故C错误;
D.等物质的量浓度的NaClO、NaHCO3混合溶液中,根据物料守恒可得:c(HClO)+c(ClO-)=c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及弱电解质的电离、盐类水解等知识点,根据弱电解质电离程度、盐类水解特点等知识点确定溶液中离子浓度大小,B为易错点,注意等pH的醋酸和盐酸对水的电离的影响相同.


科目:高中化学 来源: 题型:选择题
| A. | 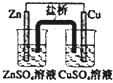 如装置中,盐桥中的K+移向CuSO4溶液 | |
| B. | 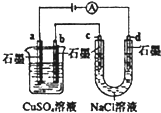 如图装置中b极析出6.4g固体时,d极产生2.24LH2 | |
| C. | 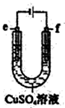 用如图装置精炼铜时,f极为粗铜 | |
| D. | 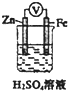 如图装置中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
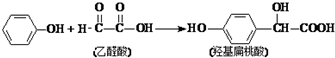
| A. | 该反应是取代反应 | |
| B. | 苯酚和羟基扁桃酸遇上FeCl3溶液都会显色 | |
| C. | 乙醛酸与H2加成的产物能在催化剂作用下形成高分子化合物 | |
| D. | 1mol羟基扁桃酸能与3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中肯定不存在.的离子是Na+和CO32- | |
| B. | 用氢氧化钠溶液可以确定阳离子的组成 | |
| C. | 溶液中加入稀硫酸,有气体产生 | |
| D. | 溶液中存在的Cl-,可用硝酸酸化的硝酸银溶液检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g甲烷含有的电子数为NA | |
| B. | 1 L0.1 mol/L NaHCO3溶液中含有的HCO3- 数目为0.1 NA | |
| C. | 1 L PH=1的硫酸溶液中含有的H+ 数为0.2 NA | |
| D. | 标准状况下,2.24 LCO和CO2混合气体中含有的氧原子数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(Na+)+c(H+) | |
| B. | 该溶液中的c(OH-)=1.0x10-3mol•L-1 | |
| C. | 加水稀释104倍所得溶液显碱性 | |
| D. | 与pH=3的HF溶液等体积混合所得溶液:c(Na+)=c (F-)+c(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 9种 | C. | 12种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:1720Cl | |
| B. | CO2的比例模型: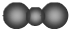 | |
| C. | 14C的原子结构示意图为 | |
| D. | CrO5的结构式为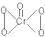 ,该氧化物中Cr为+6价 ,该氧化物中Cr为+6价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com