
| A. | 该固体中只含有NH4+、Cl-、CO32-、SO42- | |
| B. | 该固体中一定没有Cu2+、Na+、Ba2+、Cl- | |
| C. | 该固体中一定含有NH4+、Na+、CO32-、SO42- | |
| D. | 根据以上实验,无法确定该固体中含有Na+ |
分析 (1)一份固体溶于水得无色透明溶液,说明不含Cu2+;加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀,说明沉淀部分溶于盐酸,一定含有CO32-、SO42-,则一定不含Ba2+;4.66g为硫酸钡,其物质的量=$\frac{4.66g}{233g/mol}$=0.02mol,碳酸钡沉淀的物质的量=$\frac{6.63g-4.66g}{197g/mol}$=0.01mol;
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L,该气体为氨气,说明原溶液中含有铵根离子,物质的量=$\frac{0.672L}{22.4L/mol}$=0.03mol,结合电荷呈电中性分析.
解答 解:(1)一份固体溶于水得无色透明溶液,说明不含Cu2+;加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀,说明沉淀部分溶于盐酸,一定含有CO32-、SO42-,则一定不含Ba2+;4.66g为硫酸钡,其物质的量=$\frac{4.66g}{233g/mol}$=0.02mol,碳酸钡沉淀的物质的量=$\frac{6.63g-4.66g}{197g/mol}$=0.01mol;
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L,该气体为氨气,说明原溶液中含有铵根离子,物质的量=$\frac{0.672L}{22.4L/mol}$=0.03mol,
根据分析可知,每份溶液中含有0.02molSO42-、0.01molCO32-、0.03molNH4+,显然阴离子所带负电荷浓度大于阳离子所带正电荷,说明原溶液中还一定含有Na+,无法确定是否含有Cl-,
A.该固体中不一定含有Cl-,故A错误;
B.该固体中一定没有Cu2+、Ba2+,可能含有Cl-,故B错误;
C.根据分析可知,该固体中一定含有NH4+、Na+、CO32-、SO42-,故C正确;
D.根据固体呈电中性可知,一定含有Na+,故D错误;
故选C.
点评 本题考查常见离子的检验方法,题目难度中等,根据“固体或溶液中电荷显中性”推断钠离子为解答关键,注意掌握常见离子的性质及检验方法,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①④⑤ | C. | ②③④⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
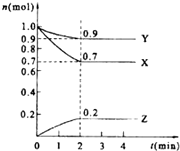 某温度时.在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时.在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有x+2 | B. | 可能是x+2 或x+10或x+24 | ||
| C. | 可能是x+24 | D. | 可能是x+2或x+12或x+26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃,5 mL 3% H2O2溶液 | |
| B. | 10℃,5 mL 5% H2O2溶液 | |
| C. | 30℃,5 mL 5% H2O2溶液 | |
| D. | 30℃,5 mL 5% H2O2溶液且加入少量MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
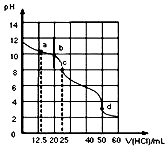 常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )
常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c点:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Na+)=0.1000mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com