
| A. | 合成氨使用高压 | B. | 制硝酸用Pt-Rh合金作催化剂 | ||
| C. | 制硫酸时接触室使用较高温度 | D. | 侯氏制碱法循环利用母液 |
分析 A.增大压强加快反应速率,且合成氨的反应为体积缩小的反应;
B.催化剂对平衡移动无影响;
C.二氧化硫的催化氧化反应为放热反应;
D.侯氏制碱法循环利用母液可提高产率,但对反应速率无影响.
解答 解:A.增大压强加快反应速率,且合成氨的反应为体积缩小的反应,则加压平衡正向移动,利用提高产率,故A正确;
B.催化剂对平衡移动无影响,不影响产率,故B错误;
C.二氧化硫的催化氧化反应为放热反应,则升高温度平衡逆向移动,产率降低,故C错误;
D.侯氏制碱法循环利用母液可提高产率,但对反应速率无影响,故D错误;
故选A.
点评 本题考查化学反应速率及化学平衡的影响因素,为高频考点,把握温度、压强、催化剂对反应的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:SO2、SiO2、NO2 | B. | 弱电解质:CH3COOH、BaCO3、Fe(OH)3 | ||
| C. | 纯净物:铝热剂、漂粉精、聚乙烯 | D. | 无机物:CaC2、石墨烯、HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
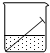
| A. | 铁钉与水面交接处最易腐蚀 | |
| B. | 铁钉发生吸氧腐蚀,铁做阴极 | |
| C. | 铁发生的反应是:Fe-3e→Fe3+ | |
| D. | 水上和水下部分的铁钉不发生电化腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于烃类 | B. | 由不同酯组成的混合物 | ||
| C. | 密度比水大 | D. | 不能发生皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| B. | 2mL10%的NaOH溶液中滴加2%的CuSO4溶液4~6滴制得新制氢氧化铜 | |
| C. | 将水蒸气通过灼热的铁粉,铁粉变红棕色,说明铁与水在高温下能发生反应 | |
| D. | 取a克Na2CO3和NaHCO3混合物与少量稀盐酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体,可测得Na2CO3质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰、明矾、烧碱 | B. | 同素异形体:石墨、C60、金刚石 | ||
| C. | 非电解质:乙醇、四氯化碳、氯气 | D. | 混合物:漂白粉、纯净矿泉水、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
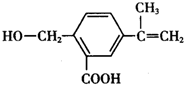 ,关于有机物M的叙述正确的是( )
,关于有机物M的叙述正确的是( )| A. | 有机物M的分子式为C11H14O3 | |
| B. | 1 molNa2CO3最多能消耗1 mol有机物M | |
| C. | 有机物M能发生取代、氧化、还原和加聚反应 | |
| D. | 有机物M能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
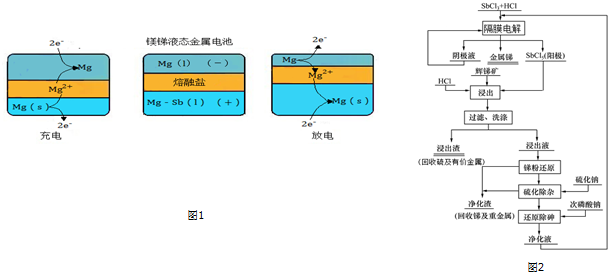
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com