
分析 (1)Al的原子结构中有3个电子层,最外层电子数为3;
(2)铝与氧化铁发生反应,生成氧化铝和Fe;
(3)反应生成偏铝酸钠和氢气.
解答 解:(1)Al的原子结构中有3个电子层,最外层电子数为3,则Al位于第三周期ⅢA族,故答案为:第三周期ⅢA族;
(2)铝与氧化铁发生反应,生成氧化铝和Fe,反应为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑,故答案为:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑.
点评 本题考查较综合,涉及Al的化学性质和化学反应方程式的书写,综合性较强,注重高频考点的考查,题目难度中等,侧重分析的考查.


科目:高中化学 来源: 题型:选择题
| A. | 该饱和溶液的物质的量浓度为5.07mol•L-1 | |
| B. | 向该溶液中加入等体积的水之后溶液的质量分数小于13.25% | |
| C. | 25℃时,密度等于1.12g•cm-3的NaCl溶液是饱和溶液 | |
| D. | 将此溶液蒸发掉部分水,再恢复到20℃时,溶液密度一定大于1.12g•cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
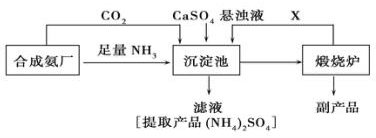
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
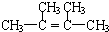 ;
;
 ;
;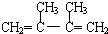 +Br2→
+Br2→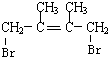 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
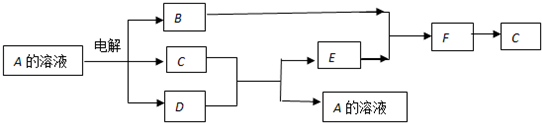
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com