
(ԭ��)������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е�λ�������ʾ������W����̬�⻯��Ħ������Ϊ34g/mol��Y����ͼ��⻯��Ϊ�ǵ���ʡ�������˵������ȷ����
| X | Y |
|
Z |
| W | Q |
A�������ӻ�ԭ�ԣ�W > Q
B��X����ͼ��⻯�����γɷ��Ӽ����
C��Q����������ˮ����ˮ��Һ������ɫϸ��ƿʢװ
D��Na��Y���γɻ�����Na2Y2������ˮ��Ӧ����Һ�ʼ���
A
��������
���������W����̬�⻯��Ħ������Ϊ34g/mol��Y����ͼ��⻯��Ϊ�ǵ���ʣ�����������ͬ����Ԫ��ΪN��S������YΪNԪ�ء�WΪSԪ�ء�XΪCԪ�ء�ZΪAlԪ�ء�QΪSԪ�ء�A�������ӵĻ�ԭ�ԣ�P3? > S2?����ȷ��B��X����ͼ��⻯��ΪCH4��CH4���Ӽ䲻���γ����������C��Q�ĵ���ΪS��S����������ˮ������D��Na��Y�����γɻ�����Na2Y2������
���㣺���⿼��Ԫ�ص��ƶϡ����ʵ����ʼ�Ӧ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014��������У����5�µ���������Կ������ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣��й����������վ������ʾ��������(PM2.5��)Ϊ������������Ӱ�������������������Ⱦ�����ҪΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
��1����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� | K+ | Na+ | NH | SO | NO | Cl�� |
Ũ��/mol?L��1 | 4��10��6 | 6��10��6 | 2��10��5 | 4��10��5 | 3��10��5 | 2��10��5 |
���ݱ������ݼ���PM2.5����������pH ���� ����
��2�� NOx������β������Ҫ��Ⱦ��֮һ����������������ʱ������N2��O2��Ӧ���������仯ʾ��ͼ���£�

�� N2(g)��O2(g) 2NO(g)��H�� ��
2NO(g)��H�� ��
�ڵ�β���п�������ʱ��NOx�ڴ�ת�����б���ԭ��N2�ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ ��
�� �������Ͳ���ȫȼ��ʱ������CO���������밴���з�Ӧ��ȥCO��
2CO(g)��2C(s)��O2(g),��֪�÷�Ӧ�ġ�H��0���������ܷ�ʵ�֣� ��
��3����ѭ�����ղ���������SO2���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�

�� �����ӷ���ʽ��ʾ��Ӧ���з����ķ�Ӧ�� ����
�� �û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������H2��Ŀ���� ��
�� ������H2���ϡ������Ͻ���Ϊ��ظ�������(��MH��ʾ����NiO(OH)��Ϊ����������ϣ�KOH��Һ��Ϊ�������Һ�����Ƶø��������������������ء���س�ŵ�ʱ���ܷ�ӦΪ��Ni(OH)2��M  NiO(OH)��MH����طŵ�ʱ�������缫��ӦʽΪ�� ���� ������ʱ��ȫ��ת��ΪNiO(OH)����������磬����һ���缫����O2��O2��ɢ����һ���缫�����缫��Ӧ�����ģ��Ӷ�������������������ر�ը��
NiO(OH)��MH����طŵ�ʱ�������缫��ӦʽΪ�� ���� ������ʱ��ȫ��ת��ΪNiO(OH)����������磬����һ���缫����O2��O2��ɢ����һ���缫�����缫��Ӧ�����ģ��Ӷ�������������������ر�ը��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014������������������ǰģ�����ۻ�ѧ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����
A��lmol Cl2ͨ�뺬��2mol FeI2����Һ�У�2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B������ʯ��ˮ������С�մ���Һ��ϣ�Ca2++OH-+ HCO3-=CaCO3��+H2O
C��AlCl3��Һ�м��������ˮ��Al3++4 OH-= AlO-2+2H2O
D����������Һ�м������������[Ag(NH3)2]++OH-+3H+= Ag++2NH4++ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����һ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��11 �֣���ԭ������Դ����������ͷ�չ����Ҫ֧�����о���ѧ��Ӧ�����е������仯����Դ��ȱ�Ľ��������Ҫ���������壬��֪�����Ȼ�ѧ����ʽ
�� | H2��g��+ | |||||||||
�� | 2H2��g��+ O2��g��= 2H2O��l�� ��H =��572kJ/mol�� | |||||||||
�� | C��s��+ | |||||||||
�� | C��s��+ O2��g��= CO2��g�� ��H =��393.5kJ/moL�� | |||||||||
�� | CO2��g��+ 2H2O��g��= CH4��g��+ 2O2��g����H = + 802kJ/moL | |||||||||
��ѧ�� | O=O | C-C | H-H | O-O | C-O | O-H | C-H | |||
����kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | |||
�ش���������
��1��д���ܱ�ʾH2ȼ���ȵ��Ȼ�ѧ����ʽ ��
��2����֪C��s��+ H2O��g�� H2��g��+ CO��g����H = ___________ kJ/moL��
H2��g��+ CO��g����H = ___________ kJ/moL��
��3�������C=O����Ϊ kJ/moL��
��4��CH4��ȼ���ȡ�H = �� ___________ kJ/moL��
��5��25�桢101kPa�£�ijȼ����CH4��ȼ��Ч����90%��ע���൱��10%��CH4δȼ�գ���ˮ����������������70%�����ô�ȼ�ߺ�ˮ�����տ�1Lˮ����Ҫ��CH4�����ʵ���Ϊ_________mol[������С�����2λ����֪��c (H2O)=4.2 J/(g����) ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����һ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ԭ������֪��HClΪǿ�ᣬ���жԱ�ʵ�鲻������֤��CH3COOHΪ�������
A���Աȵ�Ũ�ȵ��������pH
B���Աȵ�Ũ�ȵ������ᣬ����ͬ��Сþ����Ӧ�ij�ʼ����
C���Աȵ�Ũ�ȡ�������������ᣬ�����NaOH��Һ��Ӧ��ų�������
D���Աȵ�Ũ�ȡ�������������ᣬ������Zn��Ӧ������H2�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����һ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
(ԭ��) ���л�ѧ����ʹ����ȷ����
A��N2�Ľṹʽ��N = N
B��H2O�ı���ģ�ͣ�
C��HClO�ĵ���ʽ��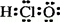
D��MgBr2���γɹ����õ���ʽ��ʾΪ��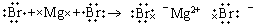
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и���˫�����Ի�ѧ�Ծ��������棩 ���ͣ������
��15�֣���1��25��ʱ��0��1 mol��L��1��HA��Һ��c(H+)/c(OH-)��1010����ش��������⣺
��HA��________(�ǿ����ʡ���������ʡ�)��
���ڼ�ˮϡ��HA��Һ�Ĺ����У�����ˮ�������Ӷ���С����________(����ĸ)��
A��c(H+)/c(HA)�� B��c(HA)/(A-) C��c(H��)��c(OH��)�ij˻� ��D��c(OH��)
����M��Һ��������HA��ҺV1 mL��pH = 12��NaOH��ҺV2 mL��ϳ�ַ�Ӧ���ã�������˵������ȷ����
A������ҺM�����ԣ�����ҺM��c(H+) + c(OH-) = 2��0��10-7 mol��L-1
B����V1 =V2 ������ҺM��pHһ������7
C������ҺM�����ԣ�V1һ������V2
D������ҺM�ʼ��ԣ�V1һ��С��V2
��2������֪��25�棬AgCl��Ksp = 1��8��10-10���ֽ�����AgCl�ֱ���룺��100 mL ����ˮ�У���100 mL 0��2mol��L-1 AgNO3��Һ�У���100 mL 0��1mol��L-1 AlCl3��Һ�У���100 mL 0��1mol��L-1�����У���ֽ������ͬ�¶���c(Ag+)�ɴ�С��˳���� ����������ӣ�
��3����1mol SO2(g)����Ϊ1mol SO3(g)�Ħ�H ����99kJ��mol��1���������ȼ����Ϊ296kJ��mol��1������S(s)����3 mol SO3(g)�Ħ�H =
��4������2NO2(g) N2O4(g) ��H < 0��Ӧ�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��������˵����ȷ���� ��
N2O4(g) ��H < 0��Ӧ�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��������˵����ȷ���� ��

�٣�A��C����ķ�Ӧ���ʣ�A>C
�ڣ�A��C�����������ɫ��A�Cdz
�ۣ�B��C����������ƽ������������B<C
�ܣ���״̬B��״̬A�������ü��ȷ���
��5����ͼ�����ü���ȼ�ϵ�ص��50 mL 2 mol��L-1���Ȼ�ͭ��Һ��װ��ʾ��ͼ��
��ش�
�� ����ȼ�ϵ�صĸ�����Ӧʽ�� ��
�� ����·����0��2 mol����ͨ��ʱ����������____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и���˫�����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����
A�� ��������Һ�м��������ˮ��Al3����3OH����Al��OH��3��
B����������Һ�еμ�Ba(OH)2��Һ��Al3+ �պó�����ȫ��2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 3BaSO4�� + 2Al(OH)3��
C��NH4HCO3���ڹ�����NaOH��Һ�У�HCO3?+OH?=CO32?+H2O
D��ϡ�����м������ۣ�2Fe��6H����2Fe3����3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��У�ڶ�ѧ����ĩ������һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ��һ����
A��H2��D2��Ϊͬ�������壻
B�� ��
�� ��Ϊͬ���칹�壻
��Ϊͬ���칹�壻
C����������춡����ͬϵ�
D�� ��
�� ��ͬһ������
��ͬһ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com