
| A、等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C、室温下,向0.01mol/LNH4HSO4 溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42->c(NH4+)>c(OH-)=c(H+) |
| D、物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,离子浓度可能的关系为:c(Na+)>c(OH-)>c(HA)>c(HB) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:


 和环状结构
和环状结构 是E的最简单的同系物.
是E的最简单的同系物.| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲组和乙组实验能观察到相同的现象 |
| B、乙组和丙组实验均能观察到蓝色沉淀 |
| C、乙组实验产生的沉淀质量比丁组多 |
| D、戊组实验产生的沉淀质量比丙组少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、0.1 mol H2O中含有电子的数目为NA |
| C、标准状况下,11.2L四氯化碳中含有分子的数目为0.5NA |
| D、0.5 mol?L-1 CaCl2溶液中的Cl-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
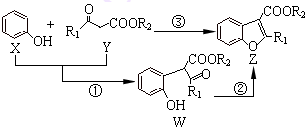
| A、反应①属于加成反应 |
| B、W中至少含有1个手性碳原子 |
| C、X、Y、W、Z这四种物质中最多有三种能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别出X和W |
查看答案和解析>>
科目:高中化学 来源: 题型:
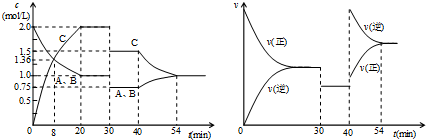
| A、30min时降低温度,40min时充入生成物C |
| B、0~8min内A的平均反应速率为0.08mol/(L?min) |
| C、反应方程式中的x=1,正反应为吸热反应 |
| D、20min~40min间该反应的平衡常数均为8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com