

 ;
; ;
;分析 由元素在周期表的位置可知,a为H,c为C,b为N,n为O,d为Na,e为Al,o为S,f为Cl,m为Ca,r为Cu,g为As,
(1)H、C、N、O、S、Cl、As为非金属,其余为金属;
(2)m为Ca;
(3)e、n二元素形成的稳定化合物为氧化铝;
(4)氨气为三角锥型;
(5)氧化钠为离子化合物;
(6)d的最高价氧化物的水化物为NaOH,e的最高价氧化物为氧化铝,二者反应生成偏铝酸钠和水.
解答 解:由元素在周期表的位置可知,a为H,c为C,b为N,n为O,d为Na,e为Al,o为S,f为Cl,m为Ca,r为Cu,g为As,
(1)在a~r11种,H、C、N、O、S、Cl、As为非金属,共7种非金属元素,Na、Al、Ca、Cu为金属,4种金属元素,故答案为:4;
(2)m为Ca,在周期表的位置为第四周期ⅡA族,故答案为:第四周期ⅡA族;
(3)e、n二元素形成的稳定化合物为氧化铝,化学式为Al2O3,故答案为:Al2O3;
(4)氨气为三角锥型,结构式为 ,故答案为:
,故答案为: ;
;
(5)氧化钠为离子化合物,用电子式表示化合物d2n的形成过程为 ,故答案为:
,故答案为: ;
;
(6)d的最高价氧化物的水化物为NaOH,e的最高价氧化物为氧化铝,二者反应生成偏铝酸钠和水,离子反应为2OH-+Al2O3=2AlO2-+H2O,
故答案为:2OH-+Al2O3=2AlO2-+H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律、元素化合物为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始滴入NaOH溶液时立即产生白色沉淀 | |
| B. | 原固体混合物中镁的质量是1.2g | |
| C. | V=100mL | |
| D. | 若将5.1g该合金溶于足量的氢氧化钠溶液,在常温常压下放出3.36L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 | |
| B. | 元素周期表中第IA族全部是金属元素 | |
| C. | 盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 | |
| D. | 硫在纯氧中的燃烧产物是三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 要提纯的物质 (杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙醇 (乙酸) | 溴苯 (溴) |
| (1)选用试剂 | ||||
| (2)分离方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g D2和足量O2反应可生成D2O 2NA个 | |
| B. | 98g H3PO4和H2SO4的混合物中含氢原子2.5NA个 | |
| C. | 6.02×1023个葡萄糖分子约含羟基6NA个 | |
| D. | 1molNa完全燃烧可转移电子NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
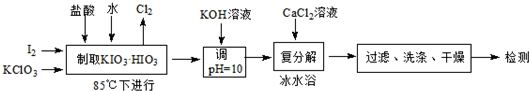
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com