
下列电离方程式中,错误的是()
| A. | H2CO3⇌H++HCO3﹣、HCO3﹣⇌H++CO32﹣ | |
| B. | H2SO4⇌2H++SO42﹣ | |
| C. | NaHCO3═Na++H++CO32﹣ | |
| D. | NaHSO4═Na++H++SO42﹣ |
| 电离方程式的书写. | |
| 分析: | 用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式.离子所带电荷数一般可根据它们在化合物中的化合价来判断.所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等. A.碳酸是弱电解质,为二元酸,分步电离; B.强电解质在溶液中全部电离,硫酸是强电解质,完全电离; C.HCO3﹣是H2CO3 D.NaHSO4为强电解质,在溶液中全部电离; |
| 解答: | 解:A.碳酸是弱电解质,电离分两步进行,两步电离程度相差很大,故电离方程式分步写,故A正确; B.硫酸是强电解质,溶液中完全电离,电离方程式为:H2SO4=2H++SO42﹣,故B错误; C.NaHCO3是H2CO3的酸式盐,HCO3﹣不能拆,电离方程式为:NaHCO3═Na++HCO3﹣,故C错误; D.硫酸氢钠属于二元强酸硫酸的酸式盐,能完全电离:NaHSO4=Na++H++SO42﹣,故D正确; 故选BC. |
| 点评: | 本题考查电离方程式的书写,书写电离方程式时注意离子的正确书写、电荷守恒、离子团不能拆开,题目难度不大. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;
S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:
2 SO2 (g)+O2 (g) 2SO3(g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
2SO3(g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:
N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。

①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是_ __。
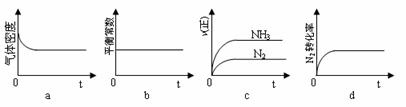
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为_______ (用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应X+2Y═R+M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为()
| A. | 16:9 | B. | 32:9 | C. | 23:9 | D. | 46:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温常压下,由A、B组成的混合气体[Mr(A)>Mr(B)],经分析混合气体中只含碳和氧两种元素.A和B不论以何种比例混合,若碳氧质量比总大于 3:8,则 A1 为CO2,B1 为CO;
若碳氧质量比总小于 3:8,则A2 为CO2,B2 为O2.
若B1和B2常温混合后,碳氧质量比总小于 3:8时,B1、B2 必须满足的关系是 n(B1):n(B2)<.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
| A. | 铜能导电,所以铜是电解质 | |
| B. | BaSO4难溶于水,但BaSO4属于强电解质 | |
| C. | 液态HCl不能导电,所以HCl是非电解质 | |
| D. | 氯气的水溶液能导电,氯气是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某 化工厂按如下步骤进行生产:①以煤为燃料煅烧石灰石;②用饱和碳酸钠溶液充分吸收步骤①中产生的二氧化碳;③使步骤①产生的氧化钙跟水反应,该厂生产过程中涉及的物质有:①石灰石;②纯碱(Na2CO3);③小苏打(NaHCO3);④烧碱;⑤二氧化碳;⑥消石灰.该厂生产过程的优点可能有:()
化工厂按如下步骤进行生产:①以煤为燃料煅烧石灰石;②用饱和碳酸钠溶液充分吸收步骤①中产生的二氧化碳;③使步骤①产生的氧化钙跟水反应,该厂生产过程中涉及的物质有:①石灰石;②纯碱(Na2CO3);③小苏打(NaHCO3);④烧碱;⑤二氧化碳;⑥消石灰.该厂生产过程的优点可能有:()
①排放的气体对大气无污染;
②生产过程中的部分产品可作为原始原料使用;
③无高温作业,其中正确的是.
| A. | 只有① | B. | 只有② | C. | ①和③ | D. | ②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
胶体具有哪些独特的性质?你知道在化学实验室里是怎么制备的吗?请完成下列问题.
(1)胶体和溶液都属于分散系,下列关于胶体和溶液的叙述正确的是D
A.溶液呈电中性,胶体带电荷
B.溶液中溶质微粒一定不带电,胶体中分解质微粒带有电荷
C.通电后溶液中溶质微粒分别向两极移动,胶体中分散质微粒向某一极移动
D.胶体是一种稳定的分散系
(2)用特殊方法把固体物质 加工到纳米级(1nm=10﹣9m)的超细粉末微粒,然后可制得纳米材料.下列分散系中的分散质的微粒直径和这种微粒的粒度具有相同数量级的是C
加工到纳米级(1nm=10﹣9m)的超细粉末微粒,然后可制得纳米材料.下列分散系中的分散质的微粒直径和这种微粒的粒度具有相同数量级的是C
A.溶液 B.悬浊液 C.胶体 D.乳浊液
(3)下列关于胶体的叙述中,不正确的是A
A.向胶体中加入蔗糖溶液,产生聚沉现象
B.可见光透过胶体时,发生丁达尔现象
C.用渗析的方法“净化”胶体时,使用的半透膜只能让分子、离子通过
D.胶体能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
(4)下列事实与胶体性质无关的是D
A.在豆浆里加入盐卤做豆腐
B.河流入海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
D.在三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
(5)请按照下面的实验步骤制备氢氧化铁胶体,体验胶体的制备.首先用烧杯取少量蒸馏水,用酒精灯加热至沸腾,然后逐渐向烧杯中滴加1mol•L﹣1FeCl3溶液,并继续煮沸至液体呈透明的红褐色即得氢氧化铁胶体.
FeCl3+3H2O⇌Fe(OH)3(胶体)+3HCl
(6)设法让一束可见光通过你所制得的胶体,检验你是否制得了胶体.除此之外,你认为还可以用什么方法判断你的胶体制备是否成功?
(7)某同学在活动过程中,边滴加FeCl3溶液边用玻璃棒搅拌,结果没有制出胶体,请你帮他分析其中的原因.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Na3N是一种重要的化合物,是由 键形成的,其中两种粒子的半径关系是:Na+ N3-(填“>”、“=”或“<”)。
(2)已知R2+离子核外有a个电子,b个中子。表示R原子符号是 。
(3)在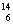 C、
C、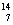 N、
N、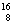 O、
O、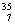 Cl、
Cl、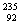 U、
U、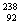 U中;互为同位素的是 。
U中;互为同位素的是 。
(4)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A. ,B. 。(填“能”或“不能”)
若能,则请你写出构成原电池的负极电极反应式_________,正极电极反应式 。
(5)KOH的电子式:: ;NH4Cl中阴离子的电子式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com