
【题目】观察下列几个装置示意图,有关叙述不正确的是( )
A.装置①中阴极上析出红色固体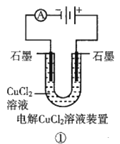
B.装置②的待镀铁制品应与电源正极相连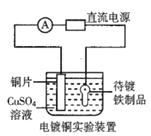
C.装置③中外电路电子由 a 极流向 b 极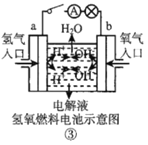
D.装置④的离子交换膜允许阳离子自由通过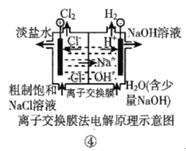
【答案】B
【解析】
A.该装置为电解池,与电源正极相连的是正极,电极反应为:2Cl--2e-=Cl2↑,与电源负极相连的是阴极,电极反应为:Cu2++2e-=Cu;
B.该装置为电镀池,待镀金属位于阴极,镀层金属位于阳极;
C.该装置为燃料电池,通入氢气的a极为负极,通入氧气的b极为正极,电池中电子由负极流向正极;
D.该装置为电解池,电解饱和食盐水,生成H2和NaOH的一极为阴极,生成Cl2的一极为阳极,阳极的阳离子穿过交换膜进入阴极。
A.该装置为电解池,与电源正极相连的是正极,电极反应为:2Cl--2e-=Cl2↑,与电源负极相连的是阴极,电极反应为:Cu2++2e-=Cu,因此阴极上析出红色固体,A项正确,不符合题意;
B.该装置为电镀池,待镀金属位于阴极,与电源的负极相连,B项错误,符合题意;
C.该装置为燃料电池,通入氢气的a极为负极,通入氧气的b极为正极,电池中电子由负极流向正极,即外电路电子由 a 极流向 b 极,C项正确,不符合题意;
D.该装置为电解池,电解饱和食盐水,生成H2和NaOH的一极为阴极,生成Cl2的一极为阳极,阳极的阳离子穿过交换膜进入阴极,为阳离子交换膜,D项正确,不符合题意;
答案选B。


科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:
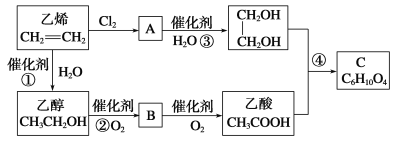
(1)①③的反应类型分别为___反应和___反应。
(2)写出反应③和④的化学方程式:
③____;④___。
(3)写出B与银氨溶液反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲可以判断出反应A(g) + B(g)![]() 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1
B. 图乙表示压强对可逆反应2A(g) + 2B(g)![]() 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
C. 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4
D. 图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得平衡后n(Cl2)=2.5×10-2 mol,10 min内υ(ClNO)=________________,则NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 ________α1(填“>”、“<”或“=”),
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I. 4NH3(g) + 5O2(g)![]() 4NO(g) + 6H2O(g) △H =-906 kJ·mol-1
4NO(g) + 6H2O(g) △H =-906 kJ·mol-1
II.4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) △H = -1266 kJ·mol-1
在1L的密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量与反应温度的关系如图所示。

①催化氧化步骤中,最适宜的温度为_________________(填“T1”或“T2” 或“T3”)
②写出N2和O2生成NO的热化学方程式________。
③温度为T2时,反应II的平衡常数K =_________________(只列算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol·L-1羟胺的酸性溶液与足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.55 mL 0.020 mol·L-1酸性KMnO4溶液完全反应。已知(未配平):FeSO4+KMnO4+H2SO4 → Fe2(SO4)+K2SO4+MnSO4+H2O,则羟胺的氧化产物是
A. N2 B. N2O C. NO D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制物质的量浓度为0.1 mol·L-1的Na2CO3溶液100 mL时,下列操作正确的是( )
A. 用托盘天平称取1.06 g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 定容时,若仰视,则所配溶液的浓度将偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有Cr2O72-,为了处理有毒的Cr2O72-,需要先测定其浓度:取20 mL废水,加入适量稀硫酸,再加入过量的V1 mL c1 mol·L-1(NH4)2Fe(SO4)2溶液,充分反应(还原产物为Cr3+)。用c2 mol·L-1 KMnO4溶液滴定过量的Fe2+至终点,消耗KMnO4溶液V2 mL。则原废水中c(Cr2O72-)为(用代数式表示)( )
A. ![]() mol·L-1B.
mol·L-1B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:

已知:Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cr(OH)3]=6.4×10-31。
(1)若以氧化物形式表示矿物的组成,则Fe2SiO4可表示为____________。
(2)焙烧时通入氧气的作用是__________________________________________
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43-、AsO43-、SiO32-反应,使其分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。测得反应pH与除杂率的关系如图所示。

①反应过程中控制溶液pH为9,pH>9时除杂率降低的原因是_________。
②反应的温度控制在80 ℃左右,温度不宜太高的主要原因是___________。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)。
①完成“还原”反应的离子方程式:________Cr2O72-+________S2O32-+________===________Cr3++________SO42-+________
②已知铬液中c(Cr2O72-)=0.32 mol·L-1,为了不在还原过程中产生Cr(OH)3沉淀,应控制溶液的pH不大于________。
(5)“沉铬”的主要副产物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常温下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com