
【题目】化合物A(分子式为C6H6O)是一种有机化工原料,在空气中易被氧化变为粉红色。A 的有关转化反应如下(部分反应条件略去):

已知: (R表示烃基)。
(R表示烃基)。
(1)写出A 的名称:________;检验A需用的试剂是__________。
(2)写出G中含氧官能团的名称:_________和_________。
(3) C的分子式_________ ;为D的结构简式为____________。
(4)F和D互为同分异构体。写出反应E→F的化学方程式:___________。
(5)某化合物是E的同分异构体,且分子中只有两种不同化学环境的氢。写出该化合物的结构简式:_______(任写一种)。
【答案】苯酚 氯化铁溶液或溴水 (酚)羟基 酯基 C6H10O ![]()
 或
或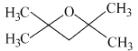
【解析】
化合物A(分子式为C6H6O)是一种有机化工原料,在空气中易被氧化变为粉红色,所以A是苯酚,结构简式为:![]() ,A在一定条件下和氢气发生加成反应生成B,B为
,A在一定条件下和氢气发生加成反应生成B,B为![]() ,B被重铬酸钾溶液氧化生成C,C为
,B被重铬酸钾溶液氧化生成C,C为![]() ,根据信息,C反应生成D,D为
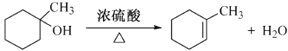
,根据信息,C反应生成D,D为![]() ,C经过一系列反应生成E,E反应生成F,F和D互为同分异构体,所以E发生消去反应生成F,则F的结构简式为:
,C经过一系列反应生成E,E反应生成F,F和D互为同分异构体,所以E发生消去反应生成F,则F的结构简式为:![]() ,据此分析解答。
,据此分析解答。
(1)根据以上分析知,A为![]() ,名称为苯酚;可以通过氯化铁溶液或溴水检验酚,加入氯化铁溶液变成紫色,或加入溴水生成白色沉淀,故答案为:苯酚;氯化铁溶液或溴水;
,名称为苯酚;可以通过氯化铁溶液或溴水检验酚,加入氯化铁溶液变成紫色,或加入溴水生成白色沉淀,故答案为:苯酚;氯化铁溶液或溴水;
(2)根据G(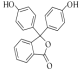 )的结构简式知,G中含有的含氧官能团有:羟基和酯基,故答案为:羟基、酯基;
)的结构简式知,G中含有的含氧官能团有:羟基和酯基,故答案为:羟基、酯基;
(3)根据上述分析,C为![]() ,分子式为C6H10O;D为
,分子式为C6H10O;D为![]() ,故答案为:C6H10O;
,故答案为:C6H10O;![]() ;
;
(4)F的结构简式为:![]() ,在加热、浓硫酸作催化剂条件下E发生消去反应生成F,所以反应E→F的化学方程式为:
,在加热、浓硫酸作催化剂条件下E发生消去反应生成F,所以反应E→F的化学方程式为: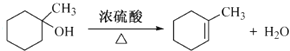 ,故答案为:
,故答案为: ;
;
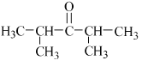
(5)E为![]() ,分子式为C7H14O,E的同分异构体的分子中只有两种不同化学环境的氢原子,符合条件的结构简式有:
,分子式为C7H14O,E的同分异构体的分子中只有两种不同化学环境的氢原子,符合条件的结构简式有: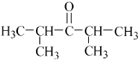 或
或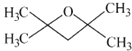 ,故答案为:
,故答案为: 或
或 。
。


科目:高中化学 来源: 题型:
【题目】次氯酸钠是家用消毒剂的有效成分。实验室制备次氯酸钠的装置如下图甲所示。

(1)装置C中生成各物质的物质的量和溶液的温度随时间的变化如图乙所示。t1分钟后所发生主要反应的化学方程式为________________________。
(2)如果要减少NaClO3的生成,可以采取的方法是_________、___________(填两种)。
(3)由装置C中的溶液得到次氯酸钠样品。假设该次氯酸钠样品中混有的杂质为NaClO3或NaCl中的一种。称取2.0225 g样品于锥形瓶中,加水使其完全溶解,向溶液中加入200 mL 0.60 mol·L-1的FeSO4溶液(过量),充分反应。再向溶液中滴加0.50 mol·L-1的KMnO4溶液,恰好完全反应时消耗KMnO4溶液20.00 mL。请计算样品中NaClO的质量分数____________(写出计算过程)。
已知:H++ClO-+Fe2+→Cl-+Fe3++H2O
H++ClO3-+Fe2+→Cl-+Fe3++H2O
H++MnO4-+Fe2+→Mn2++Fe3++H2O(以上反应均未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试

(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:

(1)常温下,下列物质能与A发生反应的有_______ (填序号)
a.乙酸 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是___________,由C→B反应类型为________ 。
(3)由A催化加氢生成M的过程中,可能生成的中间产物除了![]() 还有________(写结构简式)。
还有________(写结构简式)。
(4)检验B中是否含有C可选用的试剂是_____________。
(5)C的一种同分异构体E具有如下特点:a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子,写出E在一定条件下发生加聚反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成amol A,同时生成3amol B ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的总物质的量不再变化 ⑦单位时间消耗amol A,同时生成3amol B ⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧ B. ④⑦ C. ①③ D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为___________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
2NO2(g)+N2(g)![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
(3)800℃时,在刚性反应器中以投料比为1︰1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。

①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52min时,测得体系中p(O2)=11.4kPa,则此时的p(NO)=___________kPa, v=___________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)______(填“大于”等于”或“小于”)22.3kPa,原因是______________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)→2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)→2NO2(g) 慢反应
下列表述正确的是___________(填标号)。
A.v(第一步的逆反应)>v第二步反应
B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效
D.第二步反应活化能较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的周期性变化。
①下表中的实线是元素周期表的部分边界。请在表中用实线补全周期表的边界_____________。

②元素甲是第三周期第VIA族元索,请在右边方框中按上图中氢元素的样式写出元素甲的原子序数、元素符号、元素名称和相对原子质量(取整数)________________。
③元素乙的M层电子数比K层电子数多1,则乙原子半径与甲原子半径比较: _______>________(用元素符号表示)。甲、乙的最高价氧化物对应的水化物的酸性强弱为_______>________(用化学式表示)。
④请写出55号元素在元素周期表中的位置:_______________________________
(2) 工业合成氨的反应N2(g)+ 3H2(g)![]() 2NH3(g)是一个可逆反应、反应条件是高温、 高压,并且需要合适的催化剂。已知形成1mol H一H键、1mol N一H键、Imol
2NH3(g)是一个可逆反应、反应条件是高温、 高压,并且需要合适的催化剂。已知形成1mol H一H键、1mol N一H键、Imol ![]() 键放出的能量分别为436kJ、391kJ、946kJ。
键放出的能量分别为436kJ、391kJ、946kJ。
①若1mol N2完全反应生成NH3可____________(填“吸收”或“放出”)热量_________ kJ。
②如果将1mol N2和3mol H2混合,在一定条件下使其充分反应,测得的热量数值总小于上述数值,
其原因是_______________________________________________________________
③实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10molNH3则用N2表示的化学反应速率是_______________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请回答下列问题:
(1)常温下,物质的量浓度均为0.1mol·L-1的六种溶液
①Na2CO3、②NaCl、③NaOH、④(NH4)2SO4、⑤CH3COONa、⑥NH4NO3 , pH从大到小排列顺序为__________(填序号)。
(2)已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液bL与pH=2的H2SO4溶液aL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3, 则a :b=__________。
(3)现有HA、HB两种酸。室温下用0.1mol· L-1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如下图。

①由图可知;酸性HA______HB,b点对应的溶液中c(HB)_____c(B-)(填“>”“<”或“=”)。
②室温下HB的电离平衡常数Ka的数量级为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com