
元素周期表中前四周期的五种元素的位置关系如图示,若B元素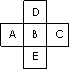 的核电荷数为Z,则五种元素的核电荷数之和可能为
的核电荷数为Z,则五种元素的核电荷数之和可能为
A 5Z B 5Z+18 C 5Z+10 D 5Z+8
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 原子最外层电子数是次外层的三倍 |
| Z | 单质及其化合物的焰色反应为黄色 |
| W | W元素基态原子的M层全充满,N层只有一个电子 |
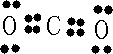
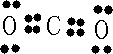
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | A的基态原子最外层电子排布式为2S22P3 |
| B | B是地壳中含量最高的元素 |
| C | C+与B的简单离子的电子层结构相同 |
| D | D的一种核素的质量数为64,中子数为35 |
| E、F | E、F既同周期又同族,且原子序数F比E多2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | Mn | Fe | |
| 电离能 ( kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
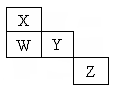 如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )
如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )| A、Z元素一定是金属元素 | B、X、Y、W一定是主族元素 | C、W的氢化物的沸点一定比X的氢化物的沸点高 | D、Z既可能在三周期,也可能在四周期 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com