
| A. | 1 mol Cl2溶于水的过程中有1NA个电子转移 | |
| B. | 100℃时,1L pH=1的硫酸溶液中,含有0.1NA个H+ | |
| C. | 常温常压下,15g HCHO含有1.5NA对共用电子对 | |
| D. | 0.1mol•L-1的醋酸溶液中CH3COO-少于0.1NA个 |
分析 A.氯气与水反应为可逆反应,不能进行到底;
B.100℃时,1L pH=1的硫酸溶液中氢离子浓度为10-1mol/L,依据n=CV计算解答;
C.1个甲醛分子含有4对共用电子对;
D.溶液体积未知.
解答 解:A.氯气溶解于水只有少部分和水反应,Cl2+H2O═HCl+HClO,1mol Cl2溶于水的过程中电子转移小于NA个,故A错误;
B.100℃时,1L pH=1的硫酸溶液中氢离子浓度为10-1mol/L,则1L pH=1的硫酸溶液中,含有氢离子物质的量为0.1mol/L×1L=0.1mol,含有0.1NA个H+,故B正确;
C.常温常压下,15g HCHO物质的量为$\frac{15g}{30g/mol}$=0.5mol,含有对共用电子对0.5mol×4=2mol,2NA对,故C错误;
D.溶液体积未知,无法计算醋酸根离子个数,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的应用,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意甲醛分子结构特点,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
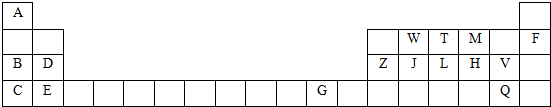
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ,d是金属晶体
,d是金属晶体查看答案和解析>>
科目:高中化学 来源: 题型:解答题
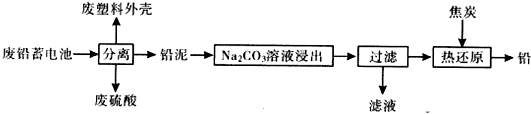
| 物质 | Ksp(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.4×10-20 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2在反应中被还原 | B. | Br2在反应中失去电子 | ||
| C. | Br2在反应中表现氧化性 | D. | 1mol氧化剂在反应中得到1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol氮气中所含的氮原子数是0.1NA | |
| B. | 标准状况下,2.24 L乙醇中所含的分子数是0.1NA | |
| C. | 1mol•L-1 氨水溶液中含NH4+的数目是NA | |
| D. | 24g镁和足量的盐酸反应,电子转移的数目是2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com