
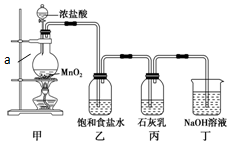
 某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.
某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.分析 甲中浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯气,氯气中混有氯化氢,通过饱和食盐水,可除去氯气中的氯化氢,氯气和石灰乳反应生成氯化钙、次氯酸钙,可用于制备漂白粉,氯气有毒,不能直接排放到空气中,可用氢氧化钠溶液吸收,以此解答该题.
解答 解:(1)由装置图可知a为分液漏斗,故答案为:分液漏斗;
(2)浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)氯化氢易挥发,制取的氯气中含有HCl,影响氯气与碱反应产物的探究,用饱和食盐水除去氯气中混有的氯化氢;
实验尾气中含有未反应的氯气,氯气有毒,直接排空,会污染空气,可以用氢氧化钠溶液吸收;
故答案为:除去氯气中混有的氯化氢;吸收Cl2防止污染空气;
(4)8.7gMnO2的物质的量为$\frac{8.7g}{87g/mol}$=0.1mol,根据方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,MnO2完全反应需要HCl的物质的量为0.4mol,小于0.1L×12mol•L-1=1.2mol,故二氧化锰完全反应,由方程式可知生成氯气0.1mol,由方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O可知,0.1mol氯气完全反应生成0.05molCa(ClO)2,
质量为0.05mol×143g.mol=7.15g;
故答案为:7.15;
(5)由题目信息可知,氯气和碱的反应为放热反应,温度过高,氯气和碱反应会生成氯酸盐,导致次氯酸盐的产率降低,可以将丙装置浸在盛有冷水的水槽中降低温度;
故答案为:将丙装置浸在盛有冰水的烧杯中.
点评 本题综合考查氯气的制取、氯气的性质,为高频考点,侧重考查学生的分析能力和实验能力,注意把握对反应装置的理解、反应条件的控制等,难度中等,注意(3)中过量计算.


科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Ca | C. | Fe | D. | Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应正反应是放热反应 | |
| B. | 该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0 | |
| C. | 在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100 | |
| D. | 工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用于制造光导纤维 | |
| B. | 盛氢氧化钠溶液的试剂瓶不能用玻璃塞 | |
| C. | 氯气可用于制取漂白粉 | |
| D. | 氢氧化铝可用于制造中和胃酸的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸 | B. | 乙醇 | C. | 甲醛 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 | |
| B. | 除去 CO2 中的 HCl 气体,只需将气体通过饱和的 Na2CO3 溶液 | |
| C. | 在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含 SO42- | |
| D. | 将 0.1mol/L 的 AlCl3 溶液 100mL 逐滴加到 0.1mol/L 的 NaOH 溶液 200ml 中与将 0.1mol/L 的 NaOH 溶液 200ml 逐滴加到 0.1mol/L 的 AlCl3溶液 100mL中,发生的现象和产生沉淀一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com