
(本题共12分)氯化钙是典型的离子型卤化物。完成下列填空:
28.氯原子核外电子排布式为 ,其原子核外能量不同的电子有 种,最外层上有 种不同运动状态的电子,钙元素在元素周期表中位于 。
某研究小组以CaCl2和H2为原料,试图制备+1价Ca的化合物,结果发现产物中只有两种化合物甲和乙。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.29%、46.41%;已知甲与水反应可得H2,乙的水溶液显酸性。
29.该研究小组是否成功制得了+1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
30.写出甲与水反应得H2的化学方程式 。现欲检验该反应所得溶液中是否含有Cl-,请简述检验的方法 。
31.乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
28. 1s22s22P63s23P5(1分);5(1分); 7(1分)第四周期ⅡA族(1分);
29.否(1分);CaHCl(1分) 30.2CaHCl + 2H2O → CaCl2 + Ca(OH)2 + 2H2↑(2分)
取样,先加过量稀HNO3溶液,再加入AgNO3溶液,若出现白色沉淀,则证明含有Cl- (2分)
31.保持FeCl2溶液呈酸性,并加入铁钉防止氧化 (2分)
【解析】
试题分析:28、氯原子的原子序数是17,根据核外电子排布规律可知氯原子核外电子排布式为1s22s22P63s23P5;核外的17个电子分别占有5种不同的能级,因此其原子核外能量不同的电子有5种。最外层上有7个电子,则有7种不同运动状态的电子。钙元素的原子序数是20,在元素周期表中位于第四周期第ⅡA族。
29、钙是第ⅡA族元素化合价只有+2价,因此不可能制得+1价化合物。甲中钙、氯元素的质量分数分别为52.29%、46.41%,这说明甲中还含有其他元素。已知甲与水反应可得H2,这说明甲中的另一种元素是H,其质量分数是1.3%,所以甲中Ca、H、Cl三种元素的原子个数之比是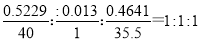 ,因此甲的化学式为CaHCl。乙的溶液显酸性,则乙的化学式是HCl。
,因此甲的化学式为CaHCl。乙的溶液显酸性,则乙的化学式是HCl。
30、甲与水生成氢气,则根据原子守恒可知还有氯化钙、氢氧化钙生成,离子方程式为2CaHCl + 2H2O → CaCl2 + Ca(OH)2 + 2H2↑。检验氯离子一般用硝酸酸化的硝酸银溶液,因此实验操作是:取样,先加过量稀HNO3溶液,再加入AgNO3溶液,若出现白色沉淀,则证明含有Cl-。
31、铁与盐酸反应生成氯化亚铁,氯化亚铁易被氧化,且亚铁离子水解显酸性,所以保存该溶液的措施是保持FeCl2溶液呈酸性,并加入铁钉防止氧化。
考点:考查核外电子排布、元素周期表、物质化学式确定以及试剂保存和离子检验等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不包含氧化还原反应的是
A.常温时浓硫酸能使铝、铁钝化 B.点制豆腐
C.食物腐败 D.燃放鞭炮
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述错误的是
A.在18g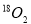 中含有
中含有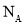 个氧原子
个氧原子
B.在反应KIO3+6HI =KI +3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述中正确的是:
A.含4.8g 碳元素的石墨晶体中的共价键数是0.8NA
B.标准状况下,11.2LCO和N2的混合气体中,含有的原子数为NA
C.1mol的羟基(-OH)与1mol的氢氧根离子(OH-)所含电子数均为9NA
D.常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:计算题
(本题共14分)某课外兴趣小组成员为研究金属铜与强酸的反应,将9.6克铜粉分为三等份,进行了如下一些实验,请完成有关计算。
54.取其中一份与100mL一定浓度的硝酸反应,待固体完全溶解,产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为0.896L。然后将剩余溶液稀释至1000mL,测得pH=0。请计算:生成的混合气体中一氧化氮的体积分数为______、反应前硝酸的物质的量浓度是__________。
55.再取另一份铜粉投入100mLpH=0的硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。求反应前混合溶液中所含硫酸的物质的量是多少?(写出计算过程)
56.用NaOH溶液吸收氮氧化物是防止NOx污染的一种方法。
原理为:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O
取最后一份铜粉溶于a mol/L过量的硝酸溶液30.0 ml中,假设硝酸的还原产物只有一氧化氮和二氧化氮。待反应结束后,将所剩溶液加水稀释至1000 m L,测得c(NO3-)=0.200 mol/L。若反应所生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
下表数据是对应物质的熔点,下列说法错误的是
编号 | ① | ② | ③ | ④ |
物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
熔点/℃ | 1291 | 160 | -107 | -40 |
A.BCl3、NCl3分子中各原子最外层都满足8电子稳定结构
B.因为键长B-F< B-Cl,故BF3的熔点高于BCl3
C.AlF3、AlCl3都是强电解质,但晶体类型不同
D.BCl3为平面正三角形分子,故它是由极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
关于三种有机物叙述错误的是(—SH的性质类似于—OH)

A.都能发生酯化反应
B.都能与NaOH反应
C.甲的苯环上的一氯代物有4种
D.丙的分子式为C10H15ON,苯环上的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:填空题
(本题共12分)铜是生命必需的元素,也是人类广泛使用的金属。
28.现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S?Fe2S3)的方法获得铜。火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 Cu2S+3SO2+2FeO,反应中被还原的元素有 ,每转移0.6mol电子,有 mol硫被氧化。产物中的SO2是一种大气污染物,可选用下列试剂中的 吸收(选填编号)。
Cu2S+3SO2+2FeO,反应中被还原的元素有 ,每转移0.6mol电子,有 mol硫被氧化。产物中的SO2是一种大气污染物,可选用下列试剂中的 吸收(选填编号)。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.CaCl2
29.Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为: 。
30.某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,则H2在 极获得(填写电极名称)。
31.向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
32.将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物 (填写化学式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:选择题
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
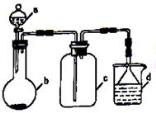
选项 | a中的物质 | b中的物质 | C中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 稀硝酸 | Cu | NO2 | H2O |
C | 稀硫酸 | FeS | H2S | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com