
”¾ĢāÄæ”潫KClŗĶCuSO4Į½ÖÖČÜŅŗµČĢå»ż»ģŗĻŗó£¬ÓĆŹÆÄ«µē¼«½ųŠŠµē½ā£¬µē½ā¹ż³ĢÖŠ£¬ČÜŅŗpHĖꏱ¼ät±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
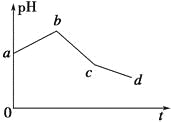
A.Õūøö¹ż³ĢÖŠĮ½µē¼«·“Ó¦2Cl££2e£=Cl2”ü”¢2H£«£«2e£=H2”ü²»æÉÄÜĶ¬Ź±·¢Éś
B.µē½āÖĮcµćŹ±£¬Ķłµē½āŅŗÖŠ¼ÓČėŹŹĮæCuCl2¹ĢĢ壬¼“æÉŹ¹µē½āŅŗ»Öø“ÖĮŌĄ“µÄÅضČ
C.ab¶Ī±ķŹ¾µē½ā¹ż³ĢÖŠH£«±»»¹Ō£¬pHÉĻÉż
D.Ō»ģŗĻČÜŅŗÖŠKClŗĶCuSO4µÄÅضČÖ®±ČĒ”ŗĆĪŖ2”Ć1
”¾“š°ø”æA
”¾½āĪö”æ
KClŗĶCuSO4Į½ÖÖČÜŅŗµČĢå»ż»ģŗĻŗó£¬ÓĆŹÆÄ«µē¼«½ųŠŠµē½ā£¬µē½ā·Ö3øö½×¶Ī£ŗ
[µŚŅ»½×¶Ī]µē½āĀČ»ÆĶ£¬Ńō¼«£ŗĀČĄė×ÓŹ§µē×Ó£¬Ņõ¼«£ŗĶĄė×ӵƵē×Ó£¬ŅņĪŖĶĄė×ÓĖ®½āŹ¹ČÜŅŗĻŌĖįŠŌ£¬Ėę×ŵē½āµÄ½ųŠŠ£¬ĶĄė×ÓµÄÅØ¶Č½µµĶ£¬ĖįŠŌ¼õČõ£¬pH½«Ōö“ó£»
[µŚ¶ž½×¶Ī]µē½āĮņĖįĶ£¬Ńō¼«£ŗĒāŃõøłĄė×ÓŹ§µē×Ó£ØĄ“Ō“ÓŚĖ®µÄµēĄė£©£¬Ņõ¼«£ŗČŌČ»ĪŖĶĄė×ӵƵē×Ó£¬ŅņĪŖĒāŃõøłĄė×ÓĻūŗÄ£¬Ź¹Ė®ČÜŅŗÖŠĒāĄė×ÓÅضČŌö“ó£¬pHŃøĖŁ¼õŠ”£»
[µŚČż½×¶Ī]µē½āĮņĖįÄĘ£¬Ńō¼«£ŗĒāŃõøłĄė×ÓŹ§µē×Ó£¬Ņõ¼«£ŗĒāĄė×ӵƵē×Ó£¬ĖüĆĒ¶¼Ą“Ō“ÓŚĖ®µÄµēĄė£¬ŹµÖŹŹĒµē½āĖ®£¬µ¼ÖĀČÜŅŗµÄĢå»ż¼õŠ”£¬Ź¹ČÜŅŗÖŠĒāĄė×ÓÅضČŌö“ó£¬pH¼ĢŠų¼õŠ”
A£®øł¾ŻŅŌÉĻ·ÖĪö£¬ĀČĄė×Ó·“Ó¦Ķź£¬ĶĄė×Ó»¹Ź££¬ĖłŅŌÕūøö¹ż³ĢÖŠĮ½µē¼«·“Ó¦£ŗ2Cl--2e-ØTCl2”ü£¬2H++2e-ØTH2”ü²»æÉÄÜĶ¬Ź±³öĻÖ£¬¹ŹAÕżČ·£»
B£®øł¾ŻŅŌÉĻ·ÖĪö£¬µē½āÖĮcµćŹ±£¬ŌŚµē½āŅŗÖŠÓ¦¼ÓČėCuCl2¹ĢĢåŗĶCuO¹ĢĢ壬¹ŹB“ķĪó£»
C£®øł¾ŻŅŌÉĻ·ÖĪö£¬ŅņĪŖĶĄė×ÓĖ®½āŹ¹ČÜŅŗĻŌĖįŠŌ£¬Ėę×ŵē½āµÄ½ųŠŠ£¬ĶĄė×ÓµÄÅØ¶Č½µµĶ£¬ĖįŠŌ¼õČõ£¬pH½«Ōö“󣬹ŹC“ķĪó£»
D£®ŅņĪŖÓɵŚ¶ž½×¶ĪŃō¼«ĒāŃõøłĄė×ÓŹ§µē×ÓµÄĶ¬Ź±£¬Ņõ¼«ČŌČ»ĪŖĶĄė×ӵƵē×Ó£¬ĖłŅŌŌ»ģŗĻČÜŅŗÖŠKClŗĶCuSO4µÄÅضČÖ®±Č²»ŹĒ2£ŗ1£¬¹ŹD“ķĪó£»
¹ŹŃ”A”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·½³ĢŹ½µÄ±ķ“ļÕżČ·µÄŹĒ
A.¼×ĶéÓėĀČĘųŌŚ¹āÕÕĻĀ·“Ó¦£ŗ![]()
B.“ĪĀČĖįŌŚĖ®ÖŠ·¢ÉśµēĄė£ŗHClO + H2O £½ H3O++ ClO-
C.Ģ¼ĖįÄĘŌŚĖ®ÖŠ·¢ÉśĖ®½ā£ŗCO32-+ 2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
D.ĀČ»Æļ§ŌŚĖ®ÖŠ·¢ÉśĖ®½ā£ŗNH4++ 2H2O![]() NH3.H2O + H3O+
NH3.H2O + H3O+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ![]() ŹĒÖʱøµē³ŲµÄÖŲŅŖŌĮĻ”£ŹŅĪĀĻĀ£¬
ŹĒÖʱøµē³ŲµÄÖŲŅŖŌĮĻ”£ŹŅĪĀĻĀ£¬![]() ČÜŅŗµÄpHĖę
ČÜŅŗµÄpHĖę![]() µÄ±ä»ÆČēĶ¼¼×ĖłŹ¾£¬
µÄ±ä»ÆČēĶ¼¼×ĖłŹ¾£¬![]() ČÜŅŗÖŠ
ČÜŅŗÖŠ![]() µÄ·Ö²¼·ÖŹż
µÄ·Ö²¼·ÖŹż![]() ĖępHµÄ±ä»ÆČēĶ¼ŅŅĖłŹ¾
ĖępHµÄ±ä»ÆČēĶ¼ŅŅĖłŹ¾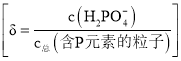 ”£
ӣ
ĻĀĮŠÓŠ¹Ų![]() ČÜŅŗµÄŠšŹöÕżČ·µÄŹĒ
ČÜŅŗµÄŠšŹöÕżČ·µÄŹĒ ![]()
![]()
A.ČÜŅŗÖŠ“ęŌŚ3øöĘ½ŗā
B.ŗ¬PŌŖĖŲµÄĮ£×ÓÓŠ![]() ”¢
”¢![]() ŗĶ
ŗĶ![]()
C.Ėę![]() Ōö“ó£¬ČÜŅŗµÄpHĆ÷ĻŌ±äŠ”
Ōö“ó£¬ČÜŅŗµÄpHĆ÷ĻŌ±äŠ”
D.ÓĆÅØ¶Č“óÓŚ![]() µÄ
µÄ![]() ČÜŅŗČܽā
ČÜŅŗČܽā![]() £¬µ±pH“ļµ½
£¬µ±pH“ļµ½![]() Ź±£¬
Ź±£¬![]() ¼øŗõČ«²æ×Ŗ»ÆĪŖ
¼øŗõČ«²æ×Ŗ»ÆĪŖ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijæĪĢā×é²ÉÓĆ»īŠŌĢæ»ŲŹÕŗ£“ų»Æ¹¤Ģįµā·ĻĖ®ÖŠ²ŠĮōµÄµĶÅØ¶Čµā(Ö÷ŅŖŅŌI©ŠĪŹ½“ęŌŚ£¬ŌÓÖŹ²»²ĪÓė·“Ó¦)£¬ŹµŃé¹ż³ĢČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
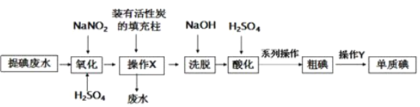
A.²Ł×÷XµÄÄæµÄŹĒø»¼Æµāµ„ÖŹ
B.æÉĶعżÕōĮóµÄ·½·ØĢį“æ“Öµā
C.¾Ļ“ĶŃŗóµÄČÜŅŗÖŠ£¬ŗ¬ÓŠ“óĮæµÄI£ŗĶ![]()
D.Ńõ»Æ²½Öč·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ6I£+2![]() +8H+£½3I2+N2”ü+4H2O
+8H+£½3I2+N2”ü+4H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃŠ¾æ±ķĆ÷£¬“óĘųÖŠµŖŃõ»ÆĪļŗĶĢ¼Ēā»ÆŗĻĪļŹÜ×ĻĶāĻß×÷ÓĆæɲśÉś¶ž“ĪĪŪČ¾Īļ”Ŗ”Ŗ¹ā»ÆѧŃĢĪķ£¬Ęä֊ijŠ©·“Ó¦¹ż³ĢČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
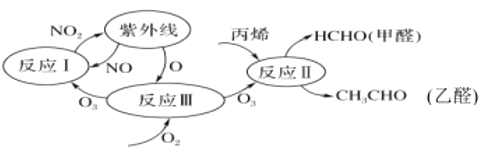
A.Õūøö¹ż³ĢÖŠO3×÷“߻ƼĮB.¹ā»ÆѧŃĢĪķÖŠŗ¬¼×Č©”¢ŅŅČ©µČĪļÖŹ
C.·“Ó¦¢óµÄ»śĄķĪŖ£ŗO2+O”śO3D.·“Ó¦¢ń”¢·“Ó¦¢ņ¾łŹōÓŚŃõ»Æ»¹Ō·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Æѧ֊Ķس£ÓĆĶ¼ĻóÖ±¹ŪµŲĆčŹö»Æѧ·“Ó¦½ų³Ģ»ņ½į¹ū”£ĻĀĮŠĶ¼Ļó¼°ĆčŹö²»ÕżČ·µÄŹĒ
A.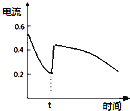 ±ķŹ¾
±ķŹ¾![]() Ōµē³Ų·“Ó¦¹ż³ĢÖŠµÄµēĮ÷Ēæ¶ČµÄ±ä»Æ£¬tŹ±æÉÄܼÓČėĮĖĖ«ŃõĖ®
Ōµē³Ų·“Ó¦¹ż³ĢÖŠµÄµēĮ÷Ēæ¶ČµÄ±ä»Æ£¬tŹ±æÉÄܼÓČėĮĖĖ«ŃõĖ®
B.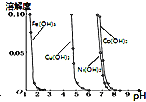 ÓÉĶ¼æÉÖŖ£¬æÉŅŌĶعżµ÷½ŚČÜŅŗpHµÄ·½·Ø³żČ„
ÓÉĶ¼æÉÖŖ£¬æÉŅŌĶعżµ÷½ŚČÜŅŗpHµÄ·½·Ø³żČ„![]() ČÜŅŗÖŠµÄ
ČÜŅŗÖŠµÄ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]()
C.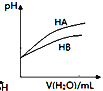 ±ķŹ¾³£ĪĀĻĀĻ”ŹĶHA”¢HBĮ½ÖÖĖįµÄĻ”ČÜŅŗŹ±£¬ČÜŅŗpHĖę¼ÓĖ®ĮæµÄ±ä»Æ£¬ŌņĻąĶ¬ÅضČĻĀČÜŅŗµÄpH£ŗ
±ķŹ¾³£ĪĀĻĀĻ”ŹĶHA”¢HBĮ½ÖÖĖįµÄĻ”ČÜŅŗŹ±£¬ČÜŅŗpHĖę¼ÓĖ®ĮæµÄ±ä»Æ£¬ŌņĻąĶ¬ÅضČĻĀČÜŅŗµÄpH£ŗ![]()
D.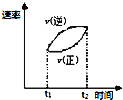 ±ķŹ¾æÉÄę·“Ó¦
±ķŹ¾æÉÄę·“Ó¦![]() £¬
£¬![]() £¬ŌŚ
£¬ŌŚ![]() Ź±æĢ¼ÓČČ£¬
Ź±æĢ¼ÓČČ£¬![]() Ź±æĢ“ļµ½ŠĀĘ½ŗā£¬ĖŁĀŹĖꏱ¼ä±ä»ÆµÄĒśĻßĶ¼
Ź±æĢ“ļµ½ŠĀĘ½ŗā£¬ĖŁĀŹĖꏱ¼ä±ä»ÆµÄĒśĻßĶ¼
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ūĶéµÄ·Ö×Ó½į¹¹æɼņŠ“³É¼üĻߏ½½į¹¹![]() £¬ÓŠ»śĪļAµÄ¼üĻߏ½½į¹¹ĪŖ
£¬ÓŠ»śĪļAµÄ¼üĻߏ½½į¹¹ĪŖ![]() £¬ÓŠ»śĪļBÓėµČĪļÖŹµÄĮæµÄH2·¢Éś¼Ó³É·“Ó¦æɵƵ½ÓŠ»śĪļA”£ĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ£Ø £©
£¬ÓŠ»śĪļBÓėµČĪļÖŹµÄĮæµÄH2·¢Éś¼Ó³É·“Ó¦æɵƵ½ÓŠ»śĪļA”£ĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ£Ø £©
A.ÓŠ»śĪļAµÄŅ»ĀČČ”“śĪļÖ»ÓŠ4ÖÖ
B.ÓĆĻµĶ³ĆüĆū·ØĆüĆūÓŠ»śĪļA£¬Ćū³ĘĪŖ2£¬2£¬3Čż¼×»łĪģĶé
C.ÓŠ»śĪļAµÄ·Ö×ÓŹ½ĪŖC8H18
D.BµÄ½į¹¹æÉÄÜÓŠ3ÖÖ£¬ĘäÖŠŅ»ÖÖĆū³ĘĪŖ3£¬4£¬4Čż¼×»ł2ĪģĻ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆøß·Ö×ÓĪüø½Ź÷Ö¬ĢįČ”Ā±Ė®ÖŠµÄµā£ØÖ÷ŅŖŅŌI£ŠĪŹ½“ęŌŚ£©µÄ¹¤ŅÕĮ÷³ĢČēĶ¼£¬Ėµ·Ø“ķĪóµÄŹĒ

A.Į÷³Ģ¢ŚµÄ·“Ó¦ĖµĆ÷¢ńµÄ·Ē½šŹōŠŌČõÓŚCl
B.¾¢ŁŗĶ¢ÜĖłµĆČÜŅŗÖŠ£¬I£µÄÅضČŗóÕß“óÓŚĒ°Õß
C.ĀČŌŖĖŲµÄĻą¶ŌŌ×ÓÖŹĮæŹĒ35.5£¬Ōņ“ęŌŚµÄ35Cl”¢37ClĖłÕ¼µÄ°Ł·Ö±ČŌ¼ĪŖ3£ŗ1
D.ČōŌŚĮ÷³Ģ¢ŚŗĶ¢ŻÖŠŅŖµĆµ½µČĮæµÄI2£¬ŌņŠčĻūŗĵÄn£ØCl2£©£ŗn£ØKClO3£©£½5£ŗ2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijæĘŃŠŠ”×éŅŌÄŃČÜŠŌ¼Ų³¤ŹÆ£ØK2OAl2O36SiO2£©ĪŖŌĮĻ£¬ĢįČ”Al2O3”¢K2CO3µČĪļÖŹ£¬¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
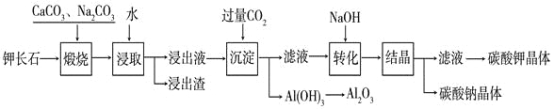
£Ø1£©ģŃÉÕ¹ż³ĢÖŠ¼Ų³¤ŹÆÖŠµÄ¼ŲŌŖĖŲŗĶĀĮŌŖĖŲŌŚNa2CO3×÷ÓĆĻĀ×Ŗ»ÆĪŖæÉČÜŠŌµÄNaAlO2ŗĶKAlO2£¬Š“³öAl2O3×Ŗ»ÆĪŖNaAlO2µÄ»Æѧ·½³ĢŹ½ŹĒ£ŗ______________________________”£
£Ø2£©ŅŃÖŖNaAlO2ŗĶKAlO2Ņ×·¢ÉśČēĻĀĖ®½ā·“Ó¦£ŗAlO2”Ŗ+ 2H2O![]() Al(OH)3 + OH”Ŗ £¬”°½žČ””±Ź±Ó¦±£³ÖČÜŅŗ³Ź___________ŠŌ£ØĢī”°Ėį”±»ņ”°¼ī”±£©”£
Al(OH)3 + OH”Ŗ £¬”°½žČ””±Ź±Ó¦±£³ÖČÜŅŗ³Ź___________ŠŌ£ØĢī”°Ėį”±»ņ”°¼ī”±£©”£
£Ø3£©”°×Ŗ»Æ”±Ź±¼ÓČėNaOHµÄÖ÷ŅŖ×÷ÓĆŹĒ______________________________£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©”£
£Ø4£©ÉĻŹö¹¤ŅÕÖŠæÉŅŌŃ»·ĄūÓƵÄÖ÷ŅŖĪļÖŹŹĒ_______________”¢_______________ŗĶĖ®”£
£Ø5£©ŅŌAl2O3ĪŖŌĮĻ£¬ŅŌŹÆÄ«ĪŖµē¼«£¬Ķعżµē½ā·ØæÉÖĘµĆ½šŹōĀĮ”£µē½ā³ŲÖŠ½ÓµēŌ“øŗ¼«µÄŅ»¼«µÄµē¼«·“Ó¦Ź½ŹĒ___________________”£³¤Ź±¼äµē½āŗ󣬊čŅŖøü»»ŠĀµÄŹÆÄ«µē¼«µÄŹĒ________¼«£ØĢī”°Ņõ”±»ņ”°Ńō”±£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com