
【题目】KMnO4是一种氧化剂,实验室常用KMnO4和浓盐酸反应制备Cl2。下图是制备NaClO溶液的装置图。

完成下列填空:
(1)医疗上可用稀高锰酸钾溶液来给伤口消毒,你认为这是利用了KMnO4的____(选填“氧化性”、“还原性”)。
(2)高锰酸钾溶于水的电离方程式为___________,它属于________(选填“强电解质”、“弱电解质”、“非电解质”)。
(3)高锰酸钾与浓盐酸制备氯气的方程式如下,标出电子转移的方向和数目________,并填空。2KMnO4 + 16HCl(浓)→2KCl + 5Cl2+ 2MnCl2+ 8H2O,反应中被氧化的元素是 ______,在标准状态下生成5.6 L的氯气,转移的电子数为__________________。
(4)B装置中饱和食盐水的作用是 ___________________________________________,D装置中NaOH的作用是 ________________________________________________。
(5)实验操作过程中可调节__________________________以控制A装置中产生Cl2的气流,C装置需控制反应温度在0~5℃,实验中可将C装置放入 __________________中。
(6)除去Cl2中混有的水蒸气和氯化氢气体,选用的药品及顺序正确的是_____________。
A.水、碱石灰 B.饱和食盐水、浓硫酸
C.无水氯化钙、饱和食盐水 D.烧碱溶液、浓硫酸
测定KMnO4纯度可用标准Na2S2O3(式量-158)溶液进行滴定,反应离子方程式为:8MnO4-+5S2O32-+14H+→10SO42-+8Mn2++7H2O。
(7)用已经准确称量过的Na2S2O3固体配制250 mL 0.1000 mol/L标准Na2S2O3溶液,供选择的仪器有:①玻璃棒 ②分液漏斗 ③胶头滴管 ④250 mL容量瓶 ⑤烧杯
⑥烧瓶,必须选用的有__________
A.②③④ B.①③④⑤ C.③④⑤⑥ D.①②④
(8)取某KMnO4(式量-158)产品0.600 g,酸化后用0.1000 mol/L标准Na2S2O3溶液进行滴定,反应最终消耗Na2S2O3溶液20.00 mL,则该KMnO4产品的纯度是_________(保留三位小数)。
【答案】氧化性 KMnO4→ K + + MnO4— 强电解质  —1价Cl 0.5NA 除HCl 尾气处理,除Cl2,防止污染环境 分液漏斗中盐酸滴速 冰水浴 B B 84. 3% 或 0.843
—1价Cl 0.5NA 除HCl 尾气处理,除Cl2,防止污染环境 分液漏斗中盐酸滴速 冰水浴 B B 84. 3% 或 0.843
【解析】
由实验装置可知,装置A为用高锰酸钾固体与浓盐酸反应制备氯气,装置B是用饱和食盐水除去氯气中混有的氯化氢,装置C氯气与氢氧化钠溶液反应制备次氯酸钠,装置D是用氢氧化钠溶液吸收有毒的氯气,防止污染环境。
(1)高锰酸钾溶液具有强氧化性,可以起到杀菌消毒的作用,医疗上可用稀高锰酸钾溶液来给伤口消毒,故答案为:氧化性;
(2)高锰酸钾是强电解质,溶于水完全电离生成钾离子和高锰酸根离子,电离方程式为KMnO4=K ++MnO4—,故答案为:KMnO4=K ++MnO4—;强电解质;
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低被还原,Cl元素的化合价升高被氧化,反应转移10e-,电子转移的方向和数目为 ;标准状态下,5.6 L的氯气的物质的量为0.25mol,则转移的电子的物质的量为0.25mol×1/5×10=0.5mol,转移的电子数为0.5NA,故答案为:
;标准状态下,5.6 L的氯气的物质的量为0.25mol,则转移的电子的物质的量为0.25mol×1/5×10=0.5mol,转移的电子数为0.5NA,故答案为: ;—1价Cl;0.5NA;
;—1价Cl;0.5NA;
(4)A装置产生氯气中含有HCl,HCl能与NaOH反应,使生成NaClO的纯度降低,必须除去HCl,因此饱和食盐水的目的是除去氯气中混有HCl;因为氯气有毒,为防止污染环境,必须除去未反应的氯气,因此装置D的作用是尾气处理,吸收多余的氯气,故答案为:除HCl;尾气处理,除Cl2,防止污染环境;
(5)控制A装置中产生Cl2的气流,可通过调节A装置中分液漏斗的活塞,通过控制滴入烧瓶中盐酸速度达到目的;因为氯气与氢氧化钠反应温度较高时,生成NaClO3,因此需要控制温度,控制温度在0-5℃,可将C装置放入冰水浴中,故答案为:分液漏斗中盐酸滴速;冰水浴;
(6)除去Cl2中混有的水蒸气和氯化氢气体,应将混合气体先通过盛有饱和食盐水的洗气瓶除去氯化氢,再通过盛有浓硫酸的洗气瓶干燥氯气,故选B,故答案为:B;
(7)用已经准确称量过的Na2S2O3固体配制250 mL 0.1000 mol/L标准Na2S2O3溶液过程中,用到的实验仪器有烧杯、玻璃棒、250mL容量瓶和胶头滴管,故选①③④⑤,故答案为:B;
(8)根据得失电子数目守恒,20.00×10-3×0.1×2×4=n(KMnO4)×5,解得n(KMnO4)=3.2×10-3mol,其质量为3.2×10-3×158g=0.5056g,产品的纯度为0.5056/0.600×100%=84.3%,故答案为:84.3%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述或操作正确的是
A. 浓硫酸具有强氧化性,稀硫酸无氧化性
B. 浓硫酸不慎沾到皮肤上,应立即用水冲洗
C. 稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌
D. 浓硫酸与铜的反应中,浓硫酸仅表现强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于氧化-还原反应的是
A. CaCO3![]() CaO+CO2↑ B. 2KI+Br2→2KBr+I2
CaO+CO2↑ B. 2KI+Br2→2KBr+I2
C. NaCl+H2SO4![]() NaHSO4+HCl↑ D. NH4Cl
NaHSO4+HCl↑ D. NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.元素周期表中元素排序的依据是元素的相对原子质量
B.元素周期表中元素排序的依据是原子的核电荷数
C.元素周期表有十六个纵行,也就是十六个族
D.元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4=Fe2O3+SO2↑+SO3↑。如将生成的混合气体通过足量Ba(NO3)2溶液,应发生的现象有( )
A.产生的沉淀只有BaSO4和BaSO3B.产生的沉淀只有BaSO4
C.一定有SO2逸出D.一定有SO3逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+
C. 边缘处:O2+2H2O+4e-=4OH-
D. 生铁片发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验操作的叙述错误的是( )
A. 用胶头滴管加液时,一般不能伸入试管中
B. 蒸馏时一般需在瓶内放一些碎瓷片
C. 温度计插入液体中测量温度的同时,又用它搅拌液体
D. 用10 mL的量筒可量取5.4mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳在石油开采、人工降雨、消防、有机合成等领域有着广泛的应用。
(1)甲醇是重要的化工原料。利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,已知反应相关的化学键键能数据如下:
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(KJ/mol) | 436 | 343 | 803 | 465 | 413 |
写出CO2和H2在催化剂作用下生成CH3OH(g)和H2O(g)的热化学方程式________
(2)CH4超干重整CO2的催化转化原理示意图如图所示:
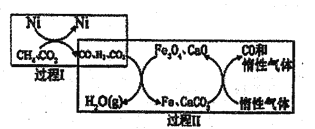
①过程Ⅰ,生成1molH2时吸收123.5kJ热量,其热化学方程式是_______
②过程Ⅱ,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com