
| A. | 该有机物的最简式为C2H3 | |
| B. | 该有机物分子中肯定不含有碳碳叁键 | |
| C. | 该有机物不可能含有氧元素 | |
| D. | 该有机物不可能是丁烷 |
分析 燃烧某有机物只生成二氧化碳8.8g和水2.7g,二氧化碳物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,由元素守恒可知该有机物分子中C、H原子数目之比为0.2mol:0.15mol×2=2:3,不能确定有机物是否含有氧元素,若为烃时,该有机物可能为C4H6等,据此判断.
解答 解:燃烧某有机物只生成二氧化碳8.8g和水2.7g,二氧化碳物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,由元素守恒可知该有机物分子中C、H原子数目之比为0.2mol:0.15mol×2=2:3.
A.不能确定有机物是否含有氧元素,该有机物的最简式不一定为C2H3,故A错误;
B.若为烃时,该有机物可能为C4H6,可能含有碳碳三键,故B错误;
C.不能确定有机物是否含有氧元素,若知道有机物的质量可以确定是否含有氧元素,故C错误;
D.若碳原子数目为4的烃,分子式为C4H6,不可能为丁烷,故D正确,
故选D.
点评 本题考查有机物分子式确定计算,侧重对质量守恒定律的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 核外电子层数相同 | B. | 半径大小顺序Na+<Mg2+<Al3+ | ||
| C. | 核外电子数相同 | D. | 最外层电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
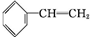 +Br2→
+Br2→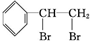 ,反应类型是加成反应.
,反应类型是加成反应. .
.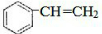 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$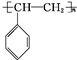 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 | |
| C. | 金属钾的晶胞空间利用率大于金属钋的晶胞空间利用率 | |
| D. | 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的最外层电子数等于其所在族的序数 | |
| B. | 元素原子的电子层等于其所在周期的序数 | |
| C. | 同一主族元素的原子最外层电子数相同,化学性质相似 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏小 | |
| B. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com