
分析 (1)低碳经济是指在可持续发展理念指导下,通过技术创新、制度创新、产业转型、新能源开发等多种手段,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态;
(2)设产生103kg氢气,相当于减排CO2X吨,结合题中信息列方程求解.
解答 解:(1)A.使用酿造酒精代替化石燃料更有利于减慢大气中二氧化碳含量的升高,符合低碳经济理念,故A正确;
B.“限塑”既遏制白色污染,又可节约石油资源、减排二氧化碳,符合低碳经济理念,故B正确;
C.“低碳经济”的理想形态是充分发展“太阳能”、“风能”、“氢能”、“生物质能”,故C正确;
D.“低碳经济”不是指能源中碳的个数少,故D错误;
故答案为:D;
(2)设产生103kg氢气,相当于减排CO2 X吨,则氢气的体积为$\frac{1{0}^{3}×1{0}^{3}g}{2g•mo{l}^{-1}}$×22.4L•mol-1,即$\frac{1{0}^{3}×1{0}^{3}}{2}$×22.4×10-3 m3,氢气耗电与二氧化碳的关系为:$\frac{1{0}^{3}×1{0}^{3}}{2}$×22.4×10-3 ×400×0.785=X×103,解得X=3516.8,
故答案为:3516.8.
点评 本题考查社会关注的化学问题,了解低碳经济理念的核心内容是解题的关键,把化学与生活、化学与环境融合到一起,提高学科综合素养,难度适中.


科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Y2-的半径要小于R- | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAt易溶于苯和四氯化碳等有机溶剂 | |
| B. | At的最高化合价为+7价 | |
| C. | At2是一种有色固体,与H2反应十分缓慢 | |
| D. | AgAt是有色固体,见光易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇,乙醇 | B. | 乙醇,1-丙醇 | C. | 2-丙醇和1-丁醇 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
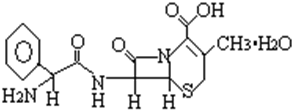 得重感冒之后,常吃一种抗生素--头孢氨苄,分子式为C16H17N3O4S•H2O,其化学结构式如图,有关其说法正确的是( )
得重感冒之后,常吃一种抗生素--头孢氨苄,分子式为C16H17N3O4S•H2O,其化学结构式如图,有关其说法正确的是( )| A. | 在一定条件下,能发生水解反应生成氨基酸 | |
| B. | 1mol该分子最多能与7molH2反应 | |
| C. | 该分子能与碳酸钠反应,不能与盐酸反应 | |
| D. | 头孢氨苄易溶于水,能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com