


分析 (1)根据图象可知pH=8时,Pb2+,Pb(OH)+和Pb(OH)2共存,另外溶液中还有H+;pH>13.2时Pb(OH)3-与氢氧根离子反应生成Pb(OH)42-;
(2)结合图象判断使废水中Pb2+尽可能转化为Pb(OH)2沉淀的最佳pH;
(3)步骤①中双氧水与铅膏(PbO2、PbSO4)反应生成碳酸铅、二氧化铅,根据铅元素的化合价变化判断双氧水反应中的作用;
(4)根据质量守恒定律判断滤液A中溶质的主要组成;
(5)用惰性电极电解时,阴极上Pb2+放电发生还原反应;
(6)从反应消耗能量大小、反应产物是否污染环境角度分析.
解答 解:(1)结合图象可知pH=8时,Pb2+,Pb(OH)+和Pb(OH)2共存,另外溶液中还有H+,所以中存在的阳离子除H+、Na+外还有Pb2+、Pb(OH)+;
pH>13.2时,Pb(OH)3-的浓度逐渐减小,Pb(OH)42-的浓度逐渐增大,说明Pb(OH)3-与氢氧根离子反应生成Pb(OH)42-,反应的离子方程式为:Pb(OH)3-+OH-=Pb(OH)42-,
故答案为:Pb2+、Pb(OH)+;Pb(OH)3-+OH-=Pb(OH)42-;
(2)结合图象可知,在pH=10时,铅元素主要以Pb(OH)2以形式存在,所以使废水中Pb2+尽可能转化为Pb(OH)2沉淀的最佳pH为10左右,
故答案为:10;
(3)步骤①中双氧水与铅膏(PbO2、PbSO4)反应生成碳酸铅、PbO,铅元素的化合价从+4变为+2,化合价降低被还原,在反应中作氧化剂,则双氧水在反应中被氧化,表现了还原性,
故答案为:还原性;
(4)碳酸铵、双氧水与PbO2、PbSO4反应生成碳酸铅、PbO,则反应后滤液中溶质应该为硫酸铵,硫酸铵可以做氮肥,也可以做工业原料,
故答案为:硫酸铵;氮肥(或工业原料)
(5)用惰性电极电解时,阴极上Pb2+放电发生还原反应,电极反应式为Pb2++2e-=Pb,
故答案为:Pb2++2e-=Pb;
(6)工业上还可以用火法回收铅:铅膏$→_{>1200℃}^{碳粉}$Ph+气体,与CX-EW法相比,火法的缺点为:消耗能量多,产生二氧化碳多,容易导致温室效应,
故答案为:产生大量温室效应气体、巨大的能量消耗.
点评 本题考查了金属回收利用、三废处理及环境保护、氧化还原反应的判断,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力,注意熟练掌握电解原理,明确氧化还原反应中氧化剂、还原剂的判断方法.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用湿润的红色石蕊试纸检验氨气 | |
| B. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| C. | 金属钠着火时,可用二氧化碳灭火器灭火 | |
| D. | Na2CO3的热稳定性大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D元素处于元素周期表中第3周期第Ⅳ族 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | B、D的最高价氧化物中,B、D与氧原子之间均为单键相连 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
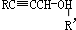
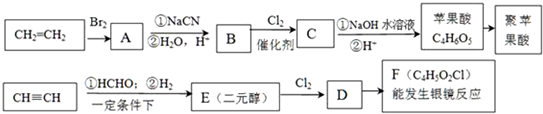
 .
.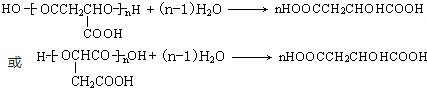 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用无毒无害的原料 | B. | 使用颜色为绿色的化工产品 | ||
| C. | 不使用任何化学物质 | D. | 使用不可再生的资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电池负极反应为:Zn-2e-═Zn2+ | B. | 锌是负极,碳棒是正极 | ||
| C. | 电子由碳棒经外电路流向锌 | D. | 锌锰干电池属一次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)的△H>0,△S<0 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g),△H=-38.6 kJ•mol-1 | |
| C. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| D. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5O-+CO2+H2O-→2C6H5OH↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com